
题目列表(包括答案和解析)
2.随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首
要原因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
( 每题只有一个选项,1-15题每题2分,16-20题每题3分,共45分 ):
1.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
22.氢气是一种新型的绿色能源,又是一种重要的化工原料。 (14分)
⑴氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142 . 9 kJ 热量。则表示H2燃烧热的热化学方程式为:
⑵氢气是燃料电池中最简单的燃料,写出氢氧燃料电池(电解质是稀硫酸)的正极反应式:____________________________________________。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
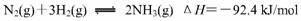
 ① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图中t1 时引起平衡移动的条件可能是
其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T℃时,将2molH2和1molN2放入0 . 5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为
③若保持温度仍为T℃,容器体积仍为0 .5L,在上述平衡态时加入1molN2和2molNH3, 试判断平衡移动方向___________________(填“不移动”或“向右移动”、“向左移动”)
(4)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景。已知通过乙醇制取氢气有如下两条路线:
a. 水蒸气催化重整:CH3CH2OH(g) + H2O(g) 4H2(g)
+ 2CO(g) △H=+255.58 kJ·mol-1
4H2(g)
+ 2CO(g) △H=+255.58 kJ·mol-1
b. 部分催化氧化:CH3CH2OH(g) +1/2 O2(g) 3H2(g)
+ 2CO(g) △H=+13.76 kJ·mol-1
3H2(g)
+ 2CO(g) △H=+13.76 kJ·mol-1
下列说法错误的是 ( )
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大.
21. 铅蓄电池是最常见的二次电池。铅蓄电池是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质溶液是稀硫酸。充电过程电能转化为化学能,放电过程化学能转化为电能。(15分)
铅蓄电池是最常见的二次电池。铅蓄电池是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质溶液是稀硫酸。充电过程电能转化为化学能,放电过程化学能转化为电能。(15分)

 (1)铅蓄电池的放、充电反应按下式进行:Pb+PbO2+2H2SO4====2PbSO4+2H2O
(1)铅蓄电池的放、充电反应按下式进行:Pb+PbO2+2H2SO4====2PbSO4+2H2O
请写出该电池在放电时的负极反应式:
(2)铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
(3)现用铅蓄电池作电源,用惰性电极电解下列溶液,则:
①电解硫酸铜溶液一段时间后,溶液pH___________(填“增大”或“减小”)
②电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是______和_____。
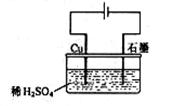 ③若改用铜作电极如右图装置电解稀硫酸溶液,则电解初期电极反应式:
③若改用铜作电极如右图装置电解稀硫酸溶液,则电解初期电极反应式:
阳极:_______________________________;
阴极:_______________________________
总反应的化学方程式为:_______________________________________________________
试预测:电解一定时间后,石墨电极上会有铜析出吗?为什么?
整个电解过程中,H+的浓度的变化趋势是
A.不断减小 B.不断增大 C.逐渐减小至一定时间后不再改变 D.无明显变化
20.在水溶液中的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-(橙红色)+H2O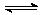 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。(8分)
(1)写出上述反应的平衡常数表达式:K=
(2)向重铬酸钾溶液中加入少量NaOH固体,溶液呈 色。
(3)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈 色,因为
。
(4)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为难溶性黄色沉淀),则平衡 (填“正向移动”、“逆向移动”或“不移动”),溶液颜色将 。
19. 把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝
把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝
片与硫酸反应产生氢气的速率与反应时间可用如右图的坐标曲线来表示,回答下列问题:(8分)
(1)曲线由0→a段不产生氢气的原因
________________________________________________;(用化学方程式表示)
(2)写出铝和酸反应的离子方程式为:______________________________________
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因
___________________________________________________________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因
____________________________________________________________________________。
18.
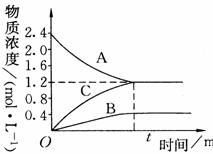 右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答: (6分)
右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答: (6分)
(1)该反应的生成物是 。
(2)该反应的化学方程式是
。
(3)若达到平衡状态的时间为2min,则A的平均速率是
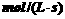 。
。
15.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g);△H<0。现将一定量NO2和
N2O4(g);△H<0。现将一定量NO2和
N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下
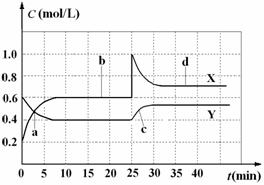 列说法错误的是
( )
列说法错误的是
( )
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若 25 min时只缩小容器体积,达到平衡时N2O4的体积分数将增大
草稿纸
厦门六中2008-2009学年下学期高二期中考
化学试卷
试卷满分100分,考试时间为90分钟
14.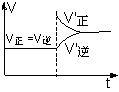 一定温度下,有可逆反应:3Fe(s)+4H2O(g)
一定温度下,有可逆反应:3Fe(s)+4H2O(g)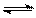 Fe3O4(s)+4H2
(g) △H>0,以下说法中正确的是
( )
Fe3O4(s)+4H2
(g) △H>0,以下说法中正确的是
( )
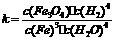 A.温度升高,H2O(g)的转化率增大
A.温度升高,H2O(g)的转化率增大
B.反应的化学平衡常数的表达式为
C.增大压强后,V正、V逆的变化如右图所示
D.多投些 Fe(s),可有效提高化学反应速率
13.在一密闭容器中,反应
aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A、平衡向逆反应方向移动了 B、平衡向正反应方向移动了
C、物质B的质量分数减小了 D、a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com