
题目列表(包括答案和解析)
25.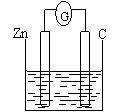 某活动小组在实验室中进行原电池构成条件的探究实验
某活动小组在实验室中进行原电池构成条件的探究实验
实验一 探究电解质溶液的浓度对原电池的影响
(用品: 表面积为3.5cm×6.0cm、厚度为1mm的锌片、石墨、
导线、J0401A型电流计、不同浓度的硫酸、500mL烧杯)。
该活动小组的同学按右上图组装实验装置,并将电极分
别插入不同浓度、等体积的硫酸中(每次所用的电极均相同)。观察的有关实验现象和测定的数据如下:
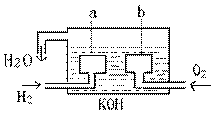
24.宇宙飞船上的氢氧燃料电池,两个电极
均由多孔碳制成(如右图),其电池反应为:
2H2+O2=2H2O, 则a为 极;
写出该电池负极电极反应: ______ ______,
若电解质溶液改为硫酸时,写出该电池的正极电极反应式:
。
23.写出钢铁发生吸氧腐蚀的电极反应式:
负极 ,
 正极
正极
22.氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
已知:H-H键能为436kJ·mol-1,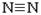 键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
19. (实验班必做题,答案写在第8页处)
(实验班必做题,答案写在第8页处)
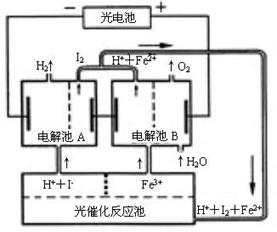
利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反
应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状
况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电
解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·min-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
08-09学年下学期高二月考化学试卷 09-3
 第II卷 (共55分)
第II卷 (共55分)

 Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ
Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ
热量,此反应的热化学方程式为:
___________________ ___________.
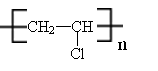
18.将等物质的量A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+ B(g)  xC(g) + 2D(g),经5min时,测得D的浓度为0.5mol/L, C(A):c(B)=3:5,
xC(g) + 2D(g),经5min时,测得D的浓度为0.5mol/L, C(A):c(B)=3:5,
C的平均反应速率是0.1mol/(L·min)。 下列说法中不正确的是
A.此时B的浓度1.25mol/L
B.反应开始前放入容器中A、B物质的量各2mol 。
C.5min内A的平均反应速率为0.15 mol/(L·min) 。
D.x值是2
17.化学反应N2+3H2=2NH3的能量变化如下右图所示,下列说法正确的是
A.该反应的热化学方程式是
1/2N2(g)+3/2H2(g)=NH3(g);
△H =-(a+b)kJ·mol-1
B.该反应的热化学方程式是
N2(g)+3H2(g)=2NH3(g);
△H =+2bkJ·mol-1
C.当使用催化剂时,
a值变小,b值不变
D.当使用催化剂时,
a值变小,b值变小
16.以惰性电极电解AgNO3溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析
出Ag的质量为
A.1.08 g B.1.28 g C.2.16 g D.4.32 g
15.已知蓄电池在放电时起原电池的作用,充电时起电解他的作用。铅蓄电池在放电和充电时发生的化学反应可用下式表示:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
据此判断下列叙述中正确的是
A.放电时铅蓄电池负极的电极反应为:PbO2+4H++SO42-十2e=PbSO4+2H2O
B.充电时铅蓄电池阴极的电极反应为;PbSO4+2e=Pb+SO42-
C.用铅蓄电池来电解CuSO4溶液,要生成3.2克Cu,电池内部要消耗0.05摩H2SO4
D.铅蓄电池充电时,若要使3.03千克PbSO4转变为Pb和PbO2,需通过20摩电子
14.下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.等量H2完全燃烧生成气态水和液态水,前者放出热量多
C.由C(石墨)→C(金刚石) ΔH = +119 kJ·mol-1可知,石墨比金刚石稳定
D.根据O2→O+O △H=+496kJ/mol可以说明:氧原子和氧分子能量一样高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com