
题目列表(包括答案和解析)
20.(6分)Ⅰ.(1)用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,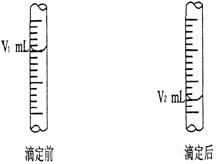 下列操作会导致测定结果偏低的是 (
)
下列操作会导致测定结果偏低的是 (
)
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,下图是酸式滴定管中液面在滴定前后的读数:则c (NaOH) = _______________。
|
次数 |
V(NaOH)/mL |
V(HCl)/mL |
|
1 |
20.48 |
22.46 |
|
2 |
25.00 |
21.98 |
|
3 |
25.00 |
22.36 |
Ⅱ.甲、乙两个同学同时设计了一份表格,用于酸碱中和滴定实验的数据记录和处理。甲同学设计的表格和实验记录结果如下:
|
次数 |
V(NaOH)/mL |
V(HCl)/mL |
||||
|
始读数V1 |
终读数V2 |
V2-V1 |
始读数V1′ |
终读数V2′ |
V2′-V1′ |
|
|
1 |
0.10 |
25.00 |
|
0.00 |
24.80 |
|
|
2 |
0.00 |
24.80 |
|
0.10 |
22.32 |
|
|
3 |
0.00 |
24.80 |
|
0.00 |
24.70 |
|
乙同学设计的表格和实验记录结果如下:
请回答下列问题:
(1)你认为甲、乙两同学设计的表格哪个比较合理 (填“甲”或“乙”),你判断的依据是 。
(2)分析你在(1)中选择的表格中的实验数据[若c(HCl)=0.10 mol·L-1 ],则测得的c(NaOH)= mol·L-1。
19. (6分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
18.(6分)⑴合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa -50 MPa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示 (T-温度)。
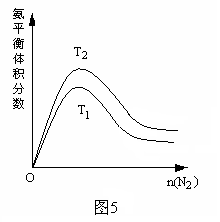
则T2_____T1 (填>、=、<),判断的依据是:______________________________________。
⑶相同温度下,有恒容密闭容器A、恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b,Q1_____ Q2, (填>、=、<)。
17.(10分)在常温下,下列五种溶液:
①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③ 0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)氯化铵溶液呈酸性的原因(用离子方程式表示)________________________________。为探究氯化铵溶液呈酸性是由NH4+引起的,请你设计一个简单的实验方案___________________________________________________________________________
_________________________________________________________________________。
(2)在上述五种溶液中,pH最小的是 ;在溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”);在溶液④中NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度____ NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
16.有一种铁的“氧化物”样品,用5 mol/L盐酸140 mL恰好完全溶解,所得溶液还能吸收标况下0.56 L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是( )
A.Fe2O3 B.Fe3O4 C.FeO D.Fe5O7
第Ⅱ卷(非选择题,共52分)
15. 常温下,将等物质的量的Mg和Al相混合,取等质量的该混合物四份分别加入到足量的下列溶液中,充分反应后放出 最多的是( )
最多的是( )
A.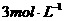 盐酸 B.
盐酸 B.
C.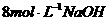 溶液
D.
溶液
D.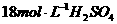
14.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
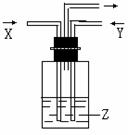
|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
CO2 |
Al2(SO42-)3 |
|
C |
NH3 |
CO2 |
CaCl2 |
|
D |
CO2 |
SO2 |
CaCl2 |
13.用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00 mL,滴定曲线如图2所示。则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol·L-1) ( )
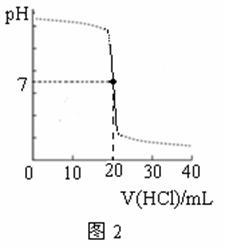
|
|
A |
B |
C |
D |
|
HCl |
0.12 |
0.10 |
0.10 |
0.08 |
|
NaOH |
0.10 |
0.12 |
0.08 |
0.10 |
12.燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,现已广泛使用,比如以甲烷为燃料的电池,其电极反应为:
负极:CH4 + 10 OH-→ CO32-+ 7H2O + 8e- 正极: O2+ 4e-+ 2H2O→4OH-
今欲得27 mL水,则电池的电子转移数量为( )
A.1mol B.2mol C.4mol D.6 mol
11.下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.0.1mol/L硫化钠溶液中:c(Na+)+ c(H+)= c(S2-)+ c(OH-)+ c(HS-)
C.0.1mol/L碳酸氢钠溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
D.相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中
c (Na+)> c (X-), 则有关系:c (HX) + c (H+) = c (Na+) + c (OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com