
题目列表(包括答案和解析)
4.碳酸铵在室温下就能自发分解产生氨气,下列有关认识正确的是
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据焓判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
3.浓度为0.1 mol/L的某物质的水溶液,其pH=5.1,则此物质可能是下列物质中的
A.H2SO4 B.NH4Cl C.NaHCO3 D.CH3COONa
2.具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p1 B.1s22s22p3 C.1s22s2sp2 D.1s22s22p63s23p4
1.下列能级中,轨道数为5的是
A.s能级 B.p能级 C.d能级 D.f能级
24.(10分)在一定温度下,在10 L的密闭容器中加入5 mol SO2和4.5 mol O2,10 min后反应达到平衡状态,此时有3 mol SO2发生了反应。试计算:
(1)用SO2表示的该反应的平均反应速率为 。
(2)平衡时,O2的转化率为 ,体系中SO3的体积分数为 。
(3)平衡时,容器内气体的压强与反应前气体的压强之比为(最简整数比) 。
(4)该反应在此温度下的平衡常数K为 。
鞍山市2008-2009学年度第一学期期末考试
23.(11分)氯酸钾是一种强氧化剂,多用来制造火柴、炸药、鞭炮和烟花等。制取氯酸钾可用以下两种方法:
第一种:无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
(1)电解池中的电极反应式是:
阴极 ,阳极 。
(2)写出生成氯酸钾的离子方程式 。
第二种:无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
(3)第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
(4)已知下列各物质的价格如下表:
(可能用到的相对原子质量:H-1 O-16 Na-23 Cl-35.5 K-39)
|
物 质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50 kg) |
500 |
1900 |
4200 |
25000 |
10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是 。
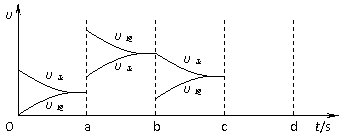
22.(6分)下图表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g) △H<0达到平衡时,由于反应条件改变而引起反应速率和化学平衡变化的情况。则a→b过程中改变的条件可能是
;b→c过程中改变的条件可能是
;若在c时刻开始增大压强,在d时刻达到平衡,请将反应速率的变化情况画在c→d处。
2SO3(g) △H<0达到平衡时,由于反应条件改变而引起反应速率和化学平衡变化的情况。则a→b过程中改变的条件可能是
;b→c过程中改变的条件可能是
;若在c时刻开始增大压强,在d时刻达到平衡,请将反应速率的变化情况画在c→d处。

21.(6分)配制FeCl2溶液时,既要加入 ,其作用是 ;又要加入 ,其作用是 。
20. (7分)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,请写出乙硼烷燃烧的热化学方程式
。又已知:H2O(l)→H2O(g) △H=+44 kJ/moL,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是
kJ。
(7分)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,请写出乙硼烷燃烧的热化学方程式
。又已知:H2O(l)→H2O(g) △H=+44 kJ/moL,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是
kJ。
19.(8分)现有:a.盐酸、b.硫酸和c.醋酸三种溶液,已知它们的pH均不大于4,物质的量浓度均不小于1×10-4 mol/L。试用代号填写下列空白:
(1)当它们的pH相同时,其物质的量浓度的关系是 ;均稀释10倍后,其pH的关系为 。
(2)在pH相同、体积也相同的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生的CO2的体积关系是 。
(3)中和同一NaOH溶液,需相同物质的量浓度的三种酸的体积关系是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com