
题目列表(包括答案和解析)
20.(12分)
设反应① 的平衡常数为
的平衡常数为 。反应②
。反应② 的平衡常数为
的平衡常数为 ,在不同温度下,
,在不同温度下, 、
、 的值如下:
的值如下:
|
温度 |
 |
 |
 |
1.47 |
2.38 |
1173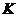 |
2.15 |
1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③ 写出该反应的平衡常数K3的数学表达
写出该反应的平衡常数K3的数学表达
式:K =____________。
=____________。
(3)根据反应①与②,可推导出K 、K
、K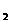 与K
与K 之间的关系式_______________。据
之间的关系式_______________。据
此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________________
(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图l、2表示该反应③在时刻t 达到平衡、在时刻t
达到平衡、在时刻t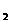 分别因改变某个条件而发生变化的
分别因改变某个条件而发生变化的
情况:

①图l中时刻t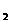 发生改变的条件是________________________________________
发生改变的条件是________________________________________
②图2中时刻t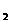 发生改变的条件是________________________________________
发生改变的条件是________________________________________
19.(6分)与化学平衡类似,电离平衡的平衡常数,叫做电离平衡常数(用K表示, K只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
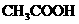 |
 |
 |
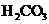 |
 |
 |
 |
 |
 |
回答下列各题:
(1)温度升高时,______________ (填“促进”或“抑制”)弱酸的电离, K值
______________ (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是:
________________________________________________________。
(3)若把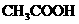 、
、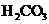 、
、 、
、 、
、 、
、 都看作是酸,则它们酸性强弱顺序是________________________________________________________。
都看作是酸,则它们酸性强弱顺序是________________________________________________________。
18.(10分)汽车内燃机工作时产生的高温会引起N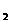 和O
和O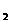 的反应:
的反应:

 ,是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
,是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
(1)右图表示在T1、T2两种不同温度下,一定量的
NO发生分解过程中N2的体积分数随时间变化的图像,
根据图像判断反应 ,为______
,为______
(填“吸热”或“放热”)反应。
(2)2000℃时,向容积为2L的密闭容器中充入
与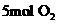 ,达到平衡后NO的物质的量为2mol,则2000℃
,达到平衡后NO的物质的量为2mol,则2000℃
时该反应的平衡常数K=__________________。该温度下,若
开始时向上述容器中充入Nz与Oz均为1 m01,则达到平衡后
N2的转化率为______________________________。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。

写出上述变化中的总化学反应方程式:____________________________________。
17.(12分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________,
K值的大小与温度的关系是:温度升高,K值__________ (填“一定增大”、“一定减小”
或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为: ,其平衡常数可表示为K:
,其平衡常数可表示为K: ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO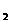 和CO的体积比____________ (选填“增大”、“减小”或“不变”,下同),平衡常数K值____________________;
和CO的体积比____________ (选填“增大”、“减小”或“不变”,下同),平衡常数K值____________________;
②1100℃时测得高炉中c(CO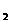 )=0.025
)=0.025  ,
, ,此时,反应是否处于化学平衡状态__________
(选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________
(选填“是”或“否”),化学反应速度 正__________
正__________
 )逆(选填“>”、“<”或“:”),其原因是③______________________________
)逆(选填“>”、“<”或“:”),其原因是③______________________________
16.(12分)(1)(4分)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①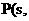 白磷
白磷

②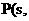 红磷
红磷

写出白磷转化为红磷的热化学方程式:__________________________。则对应下
列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_____________。


(2)(8分)有右图装置:回答下列问题:
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上
的电极反应方程式为:__________________。
③锌与铁组成的合金在潮湿的空气中,
锌被腐蚀而另一种金属被保护,这种保护方法叫
做_______,正极反应式为__________________ 。
④装置B中是浓度均为 的NaCl、CuSO
的NaCl、CuSO 混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C
混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C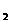 上质量增加____________g;
上质量增加____________g;
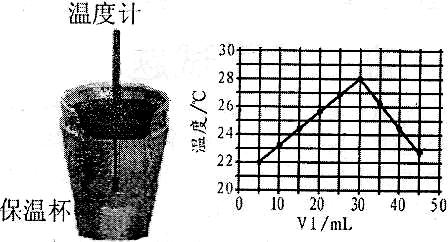
15.(12分)某化学学习小组在实验室里利用下图装置测定中和反应中的热效应。实验时将 溶液和
溶液和 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持
未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持 )。
)。
据此请回答下列问题:
第 15 题 图
(1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
(2)保温杯的作用是_______________________________________________________。
(3)某同学根据所得数据,提出了以下观点,其中正确的是______________________。
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.该实验表明有水生成的反应都是放热反应
(4)利用图中所给数据,可测得NaOH溶液的浓度约为______________
(5)除了使用保温杯外,为了保证实验成功,还要注意哪些问题(说出2点即
可) ____________________________、____________________________?
14.已知:①lmolH 分子中化学键断裂时需要吸收436 kJ的能量②1 mol C1
分子中化学键断裂时需要吸收436 kJ的能量②1 mol C1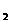 分子中化学键断裂时需要吸收243 kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是
分子中化学键断裂时需要吸收243 kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是:

B.氢气和氯气反应生成2 mol氯化氢气体,反应的
C.氢气和氯气反应生成2mol氯化氢气体,反应的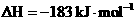
D.氢气和氯气反应生成1 mol氯化氢气气体,反应的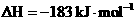
非选择题(72分)
13.下列离子反应方程式正确的是
A.用澄清石灰水吸收氯气:
B.将金属钠加入冷水中:
C.向稀硝酸中加入少量铁粉:
D.用铜做阳极电解氯化铜溶液: 
12.在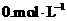 的醋酸溶液中,存在平衡:
的醋酸溶液中,存在平衡: 下列说法正确的是
下列说法正确的是
A.加水稀释,中和此溶液所需的 NaOH溶液的体积增大
NaOH溶液的体积增大
B.加入固体碳酸钠,平衡正向移动, 减小
减小
C.加入固体醋酸钠,平衡逆向移动, 均减小
均减小
D.加水稀释,电离程度增大,由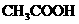 电离出来的
电离出来的 增大
增大
11.在一定温度下,可逆反应 达到
达到
平衡的标志是
A.Z生成的速率与Z分解的速率相等 B.单位时间生成n mol X,同时生成2n mol Y
C.X、Y、Z的浓度不再变化 D.X、Y、Z的分子数之比为l:2:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com