
题目列表(包括答案和解析)
26、(9分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。 G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a、滴定操作的正确顺序是(用序号填写): ① 。
b、该滴定操作中应选用的指示剂是: ② 。
c、在G操作中如何确定终点? ③ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ④,原因是 ⑤ 。
 (3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位) ⑥ mol/L
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位) ⑥ mol/L
25、(5分)日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为:① 。
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,
AG=lg[c(H+)/c(OH-)]。
(2)中性溶液的AG=② 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG=③ ,由水电离的c(H+)= ④ 。
24、(5分)在固定容积的密闭容器中,有可逆反应nA(g)+mB(g) pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值① ,混合气体的密度② ;降温时,混合气体的平均相对分子质量③ ;加入催化剂,气体的总物质的量④ ;充入C,则A、B的物质的量⑤ 。(增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值① ,混合气体的密度② ;降温时,混合气体的平均相对分子质量③ ;加入催化剂,气体的总物质的量④ ;充入C,则A、B的物质的量⑤ 。(增大、减小、不变、不确定)
23、(5分)可逆反应3A(g) 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量 ① ;
b.若B、C都不是气体,气体的平均相对分子质量 ② ;
c.若B是气体,C不是气体,气体的平均相对分子质量 ③ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④ 态,C是⑤ 态。
22、(5分)化学电池分为 ① ,② ,③ ,其中碱性锌锰电池属于④ ,铅蓄电池属于⑤ 。
21、(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+1/3CO(g)==
2/3Fe3O4(s)+C02(g) △H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:①。
22. (8分)分子组成符合CnH2n-2的某烃,分子结构中无支链和侧链。完全燃烧时所消耗的氧气的体积是相同状况下该烃蒸气体积的8.5倍。
(1)求该烃的分子式
(2)若该烃为链状烯烃,且与等物质的量的Br2加成后只能得到单一的产物,试推断并写出其结构简式:
(3)若该烃只能与等物质的量的Br2发生加成反应,试写出其结构简式。
21.( 10分)X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如下图所示:
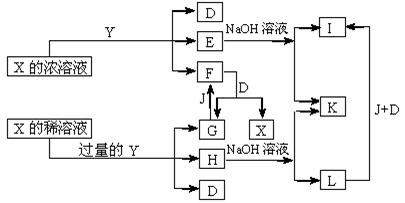
已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色。请回答:
(1)Y和X浓溶液反应的条件是 ,而常温下难反应的原因是 。
(2)写出F和G相互转化的化学方程式:
F→G+X G→F
(3)L转化成I的现象是 ,有关的化学方程式是 。
20.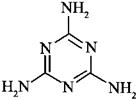 (9分)三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”。三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃。三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺。与该法相比,尿素法成本低,目前较多采用。尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6
CO(NH2)2 → C3N6H6
+ 6 NH3 + 3 CO2
(9分)三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”。三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃。三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺。与该法相比,尿素法成本低,目前较多采用。尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6
CO(NH2)2 → C3N6H6
+ 6 NH3 + 3 CO2
试回答下列问题:
(1)原子数和电子总数都相等的粒子互称为等电子体,它们具有相似的结构特征,与CN22-互为等电子体的中性分子有N2O和 (填化学式),由此可以推知CN22-离子的空间构型为 ;
(2)写出由电石和N2在加热条件下反应制备氰胺化钙的化学方程式:
;
若通过上述反应制备400g氰胺化钙,则转移的电子数为 mol;
(3)三聚氰胺难溶于冷水但易溶于热水,以尿素为原料制得的三聚氰胺粗产品中既含有不溶于水的杂质,又含有易溶于水的杂质,简述从粗产品中提纯三聚氰胺的方法:
(4)在奶粉中掺入三聚氰胺后不易被发现的原因是
19.(8分)在化工生产中,要用到一种无色、可溶于水的晶体:铝铵矾。该晶体是一种复盐,其主要成分是十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。已知NH4+和AlO2-在水溶液中不能大量共存:
NH4+ + AlO2-+H2O=Al(OH)3↓+NH3↑
试回答:(1)在逐滴加入浓NaOH溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气味的气体产生;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少。
请答出各种现象由先到后出现的顺序(用序号回答)____→____→____→____→____;
 (2)写出滴入NaOH溶液的过程中,有关反应的离子方程式:
(2)写出滴入NaOH溶液的过程中,有关反应的离子方程式:
①__ __
②_ _;
③__ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com