
题目列表(包括答案和解析)
2、化学反应2X(g) =2Y(g)+Z(g)(吸热反应),要使正反应速率降低,X的浓度增大应采取的措施是 ( )
A.减少Z的浓度 B.减压 C.降温 D.加压
1、下列说法或表示方法正确的是 ( )
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B、由C(石墨)→C(金刚石):ΔH = +119 kJ· mol-1可知,金刚石比石墨稳定
C、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol-1
D、在稀溶液中:H++OH-===H2O;ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol KOH的溶液混合,放出的热量大于57.3 kJ
(A、B、C表示)。
27.(7分)将一定量的KNO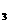 和Cu(NO
和Cu(NO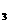 )
) 的混合溶液用石墨作电极进行电解,当通电一段时间后,两极共收集到1.12 L气体(标准状况),其中阴、阳两极气体的体积比为3:2,电解后溶液体积为200 mL。
的混合溶液用石墨作电极进行电解,当通电一段时间后,两极共收集到1.12 L气体(标准状况),其中阴、阳两极气体的体积比为3:2,电解后溶液体积为200 mL。
求:(1)析出的Cu的质量(Cu的相对原子质量:64)
(2)电解后溶液的PH。
2008--2009学年度上学期期末考试高二试题
26.(10分)A、B、C、D是由Ba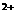 、K
、K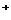 、A1
、A1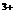 、OH
、OH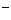 、CO
、CO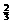
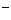 、SO
、SO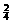
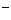 、C1
、C1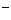 、中的2种离子组成的可溶于水的4种化合物。
、中的2种离子组成的可溶于水的4种化合物。
(1)用PH试纸检验4种化合物的水溶液,A、B呈碱性,c呈中性,D呈酸性,D中所含阳离子为__________________,用离子方程式说明溶液呈酸性的原因_______________________.
(2)取D溶液于3支试管中,分别慢慢滴加A、B和C的溶液,出现的现象如下
加入A:出现白色沉淀,A过量时沉淀部分溶解
加入B:既有白色沉淀产生,又有气体产生
加入C:无明显变化
写出A、B、c的化学式:A ____________,B___________,C__________ ;A、B、C水溶液中水的电离程度由大到小的顺序为___________________________(A,B,C表示)。
写出B、D反应的离子方程式______________________.
25.(8分)右图为向25mLO.lmoI/LHCl溶液中滴加O.2mol/L的氨水的过程中PH的变化曲线。请回答下列问题:
(1)B点呈中性,是否说明盐酸与氨水恰好反应?________(填“是”或“否”)。
若不是,则二者恰好反应的点在AB区间还是在BD区间?________________
若是,理由是_____________________________.
(2)关于该滴定实验,从下列选项中选出最恰当的一项____________(填序号)
|
|
① |
② |
③ |
④ |
|
锥形瓶中溶液 |
酸 |
碱 |
酸 |
碱 |
|
滴定管中溶液 |
碱 |
酸 |
碱 |
酸 |
|
选用滴定管 |
乙 |
田 |
甲 |
乙 |

(3)在AB区间c(NH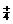 )--c(C1
)--c(C1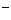 )(填“>”、“<”或“一”)。在D点时,溶液中C(NH
)(填“>”、“<”或“一”)。在D点时,溶液中C(NH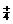 )+c(NH
)+c(NH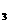 ·H
·H O)__________2c(C1
O)__________2c(C1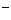 )。
)。
24.(9分)随着人们对温室效应和能源短缺等问题的重视,如何降低大气中CO 的含量及
的含量及
有效地开发利用CO 的问题,引起了普遍重视。
的问题,引起了普遍重视。
(1)目前工业上有一种方法是用CO 来生产燃料甲醇,为了探究反应原理,现进行如下
来生产燃料甲醇,为了探究反应原理,现进行如下
实验:在容积为lL的密闭容器中充入lmol CO 和3mol H
和3mol H 在一定条件下发生反应
在一定条件下发生反应
CO (g)+3H
(g)+3H (g);DCH
(g);DCH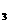 OH(g)+H
OH(g)+H O(g)△H=一49.okJ/mol。测得CO
O(g)△H=一49.okJ/mol。测得CO 和
和
CH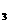 OH(g)的浓度随时间的变化关系如图所示。
OH(g)的浓度随时间的变化关系如图所示。
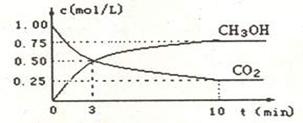
①从反应开始到达到平衡,氢气的平均反应速率v(H2)=_________。
②该反应的平衡常数表达式为_________________。
③下列措施中能使n(CH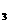 OH)/n(CO
OH)/n(CO )增大的是__________(填代号)
)增大的是__________(填代号)
A.再充入1molCO 和3molH
和3molH ,
,
B.升高温度
C.充入He(g),使体系压强增大
D.将H O(g)从体系中分离
O(g)从体系中分离
(2)在载人航天器的生态系统中,不仅要求除去CO ,还要提供充足的O
,还要提供充足的O 。某种电化学装
。某种电化学装
置可以实现2CO =2CO+O
=2CO+O 的转化,这种装置中发生还原反应的电极叫_______________。
的转化,这种装置中发生还原反应的电极叫_______________。
有人设计反应2CO=O +2C(△H>O,△S<0)来消除CO的污染。请判断是否可行,
+2C(△H>O,△S<0)来消除CO的污染。请判断是否可行,
并说明理由
23.(6分)肼(N H
H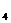 )又称联氨,是一种可燃性的液体,可用作火箭燃料。又知NH
)又称联氨,是一种可燃性的液体,可用作火箭燃料。又知NH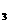 与
与
N  H
H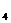 、NH
、NH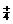 与N
与N H
H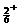 的性质具有某些相似性。
的性质具有某些相似性。
(1)已知在1 01kPa、25℃时,8.0gN H
H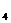 在氧气中完全燃烧生成氮气和液态水,放出热量356kJ,请写出浚反应的热化学方程式:_______________________________。
在氧气中完全燃烧生成氮气和液态水,放出热量356kJ,请写出浚反应的热化学方程式:_______________________________。
(2)写出N H
H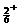 与足量NaOH溶液反应的离子方程式__________________________。
与足量NaOH溶液反应的离子方程式__________________________。
(3)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KoH溶液。
肼一空气燃料电池放电时正极的电极反应式:______________________________________________ 。
22.(10分)为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、直流电源、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与
锌金属活动性相对强弱的系列实验。试填写下列空白: :
(1)甲同学将铜片和锌片插入盛有稀硫酸的烧杯中(铜与锌不接触),观察到的现象是__________________________________________________________________.
(2)乙同学接着甲同学的实验,用导线将铜片和锌片连接起来组成原电池,此时在正极上观察到的现象是_______________________________________________,负极
的电极反应式为__________________________________________________.
(3)丙同学接着乙同学实验,去掉连接铜片和锌片的导线,将铜片和锌片分别与同一直流电源的正极和负极连接,再向烧杯中加入一定量的CusO4溶液进行电解。此时阴极的电极反应式为________________________________________,电解过程中溶液的PH_____________________________(填“增大”、“减小”或“不变”)。
(4)甲、乙、丙3位同学能达到比较铜和锌的金属活动性相对强弱的目的的是__________.
A.只有甲同学 B.甲和乙同学
C.乙和丙同学 D.甲、乙和丙同学
1.0×l0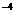 m01/L的AgNO
m01/L的AgNO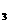 溶液。已知AgCI的K
溶液。已知AgCI的K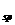 -1.8×10
-1.8×10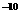 ,下列说法正确的是
,下列说法正确的是
A.无AgCl沉淀产生
B.有Agcl沉淀产生
c.有沉淀产生但不是AgcI沉淀
D.无法确定
21.向lL浓度均为1.0×10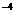 m0 1/L的KCl和KF的混合溶液中加入lmL
m0 1/L的KCl和KF的混合溶液中加入lmL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com