
题目列表(包括答案和解析)
1.当前我国环保急待解决的“白色污染”通常指的是 ( )
A.大米等白色食品安全问题 B.石灰窑的白色粉尘
C.聚乙烯等塑料垃圾 D.白色建筑废料
25.蛋白质中的氮元素可转化为氨析出,现有30ml牛奶进行实验,生成的氨用50.0ml 0.500mol/l的硫酸溶液吸收,剩余的酸用38.0ml 1.00mol/l的氢氧化钠溶液可恰好完全中和。问:
(1) 30ml牛奶中共含有多少克氮?
(2)若蛋白质中含氮16%(质量分数), 则牛奶中蛋白质的质量分数是多少?(已知牛奶的密度是1.03g/ml)
24.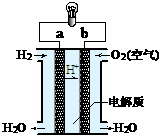 如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:
如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:
负极:2H2-4e-+4OH-=4H2O 正极:O2 + 2H2O+4e-= 4OH- ,所产生的水可作为饮用水,今欲得常温下1L这样的水,求电池内转移电子得物质的量大约是多少?
23.现有九种有机物:① 乙醇 ② 甲苯 ③ 氨基乙酸 ④ 甘油 ⑤ 甲烷 ⑥ 甲醛 ⑦ 甲酸 ⑧ 乙烯 ⑨ 乙炔,将序号填入下列相应的空格中:
(1)可以作为制取炸药原料的是________;(2)常温下能与Na发生反应的是_________;
(3)能使酸性高锰酸钾溶液褪色的是_____________;(4)能发生银镜反应的是___________;
(5)能发生缩聚反应的是___________________。
22.某温度下,在一固定容积的容器中进行如下反应N2+3H2 2NH3,下列情况一定能说明反应已达到限度的是: 。(填序号)
①单位时间内,有1molN2反应掉,同时有1molN2生成。
②单位时间内,有3molH2反应掉,同时有2molNH3反应掉。
③单位时间内,有1molN2生成,同时有2molNH3生成。
④单位时间内,有1molN2生成,同时有3molH2生成。
⑤用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比为1:3:2。
⑥容器内气体的总质量不再改变。
⑦容器内,C(N2)、C(H2)、C(NH3)不再改变。
21.化学反应速率的决定因素式化学物质本身的结构与性质,也有很多外界因素影响化学反应速率,如温度、催化剂等。请根据下列反应现象指出各变化的主要外界影响因素?
(1)硫在O2中比在空气中燃烧剧烈: ;
(2)卤化银要保存在棕色试剂瓶中 ;
(3)MnO2加入双氧化水中反应更剧烈 ;
(4)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完 ;
(5)在相同温度下,粗锌、纯锌分别与相同浓度的盐酸反应,粗锌反应速率更快
 。
。
20.利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池:
(1)正极用 作电极,电极反应式: ;
(2)负极用 作电极,电极反应式: ;
(3)画出装置图(标明电解质溶液、正、负极)
19.下表是元素周期表的一部分:
 族 族 |
I A |
II A |
III A |
IV A |
V
A |
VI A |
VII A |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
⑦ |
⑧ |
⑨ |
⑩ |
|
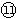 |
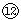 |
(1)表中元素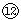 的氢化物的化学式为___________,此氢化物的还原性比元素
的氢化物的化学式为___________,此氢化物的还原性比元素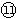 的氢化物的还原性_______________(填强或弱)。
的氢化物的还原性_______________(填强或弱)。
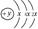 (2)某元素的原子结构示意图为: ,该位于周期表 周期
族;
(2)某元素的原子结构示意图为: ,该位于周期表 周期
族;
元素名称为 ,其气态氢化物的结构式为 。
(3)⑤与⑧可形成A3B2构型的离子化合物,用电子式表示其形成过程: 。
(4)写出⑦与⑨、⑦与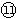 、⑨与
、⑨与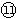 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨:
、⑦与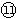 :
、
:
、
⑨与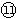 。
。
18、下列物质中,在一定条件下能和氢氧化钠溶液发生反应的是 ( )
A、乙醇 B、乙酸 C、油脂 D、汽油
第II卷
17.温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率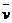 (x)为
( )
(x)为
( )
A、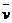 (O2)=0.01 mol/(L•s) B、
(O2)=0.01 mol/(L•s) B、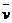 (NO)=0.08 mol/(L•s)
(NO)=0.08 mol/(L•s)
C、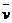 (H2O)=0.003 mol/(L•s) D、
(H2O)=0.003 mol/(L•s) D、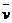 (NH3)=0.002 mol/(L•s)
(NH3)=0.002 mol/(L•s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com