
题目列表(包括答案和解析)
12.可以将六种无色液体:C2H5OH溶液、AgNO3溶液、C2H5Br、KI溶液、C6H5OH溶液、苯一一区分开的试剂是 ( )
A、FeCl3溶液 B、溴水 C、酸性高锰酸钾溶液 D、NaOH溶液
11.能够鉴定氯乙烷中氯元素的存在的操作是 ( )
A、在氯乙烷中直接加入AgNO3溶液 B、加蒸馏水,然后加入AgNO3溶液
C、加入NaOH水溶液,加热,然后加入AgNO3溶液
D、加入NaOH的乙醇溶液,加热后稀硝酸酸化,然后加入AgNO3溶液
22.(共8分)某同学为了测定一部分氧化的亚硫酸钠的样品,做如下实验:
(1)称取样品11.72g溶于水配成100mL溶液;
(2)取试液25mL,向其中加入足量的氯化钡溶液;
(3)过滤、洗涤、烘干,称得沉淀质量为4.5g。
试求原样品中亚硫酸钠的质量分数
21.(8分)碱式碳酸镁有多种不同的组成,如: Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组同学为确定某种碱式碳酸镁的组成,设计下图所示的实验装置。
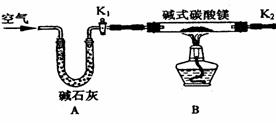
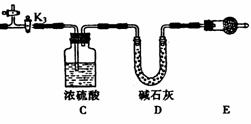
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________。E处干燥管盛放的药品是_______________________________。
②称取碱式碳酸镁样品ml g,并将其放入硬质玻璃管中,称量:装浓硫酸的洗气瓶C的质量为m2 g,装碱石灰的U型管D的质量为m3 g。
③打开活塞_________________,关闭_________________,缓缓鼓入空气数分钟。
④关闭活塞_________________,打开_________________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4 g:U 型管D的质量为m5 g.
实验测得数据如下:ml=31 g,m2=87.6 g,m3=74.7 g,m4=89.4 g,m5=87.9 g。
计算推导:该碱式碳酸镁的化学式为_________________________________。
(2)关于该实验方案,以下说法你认为正确的是______________________(填字母)。
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[a Na2CO3·b NaHCO3·c H2O(a、b、c为正整数)]的化学组成。
20.(5分)下表是第三周期某元素的逐级失去电子的电离能数据(I1表示第一电离能,I2表示第二电离能,其余类推,电离能的单位为:KJ·mol-1:
|
|
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
I7 |
… |
|
电离能 |
578 |
1817 |
2745 |
11575 |
14830 |
18376 |
23293 |
|
回答下列问题:
(1)为什么原子的逐级电离能越来越大 。
(2)你推断该元素是 元素,理由 。
(3)已知该元素和氯元素形成的化合物在一定的温度下能转化为气体,其摩尔质量为267g/mol,则该氯化物的分子式为 ,经分析,分子中存在配位键,画出它的结构式 。
19.(12分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
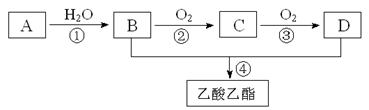
回答下列问题:
①写出A的电子式 。
②B、D分子中的官能团名称分别是 、 。
③写出下列反应的反应类型名称:① ,② ,④ 。
④写出下列反应的化学方程式:
① ;
② ;
④ 。
15.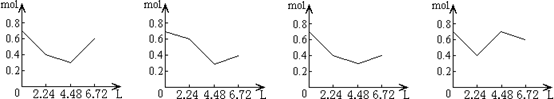 往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(S.T.P)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计) ( )
往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(S.T.P)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计) ( )
A B C D

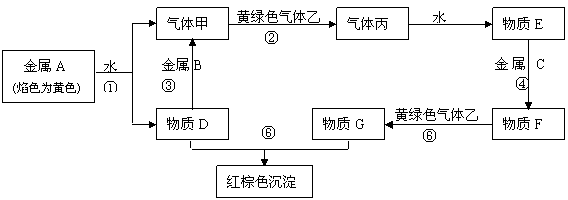
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、 B 、C 、F 、 H 、 乙 。
(2)写出下列反应化学方程式:
反应① 。
反应⑤ 。
反应⑥ 。
14.已知乙烯分子中碳原子以3个sp2杂化轨道与碳原子或氢原子形成σ键,两个碳原子上未参与杂化的p轨道形成π键。下列关于乙烯分子的叙述中正确的是( )
A.乙烯分子2个碳原子和4个氢原子不可能在同一个平面内
B.乙烯分子中键角约为109°28′,所有原子在同一个平面内
C.乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小
D.乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应
13.下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质.化学性质均相同
12.共价键.离子键和范德华力都是微观粒子之间的不同作用力,下列晶体:
①Na2O2;②SiO2;③石墨;④金刚石;⑤CaF2;⑥白磷,其中含有上述任意两种结合力的组合是 ( )
A.①③⑤⑥ B.①③⑥ C.②④⑥ D.①②③⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com