
题目列表(包括答案和解析)
18. a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
A.22.4bc×10-3 B.44.8bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
17.经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法正确的是
A.溶液中四种粒子之间一定满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液离子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定是NH4Cl和NH3·H2O
C.若溶液离子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl
D.若溶液离子间满足:c(NH4+)=c(Cl-)则溶液中一定呈中性
16、合成氧工业对国民经济和社会发展具有重要的意义对于密闭容器中的反应:
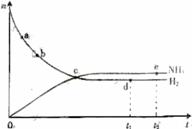 N2(g)+3H2(g)
N2(g)+3H2(g)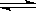 2NH3(g)
400℃、30Mpa下n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是
2NH3(g)
400℃、30Mpa下n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是
A 点a的反应速率比点b的大
B 点c处反应达到平衡
C 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D 其他条件不变,在500℃温度下反应至t1时刻,n(H2)比上图中d点的值大
15.气态烃A最多和2摩尔HCl加成,生成氯代烷B,1摩尔B与6摩尔Cl2发生取代反应,生成只含碳、氯两种元素的C。则A的分子式为 A.C2H2 B.C2H4 C.C3H4 D.C4H6
14.燃料电池能连续不断地提供电能,且能量转化率远高于普通燃烧过程,因而具有广阔的发展前途。下列有关以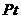 作电极的氢氧燃料电池工作时的说法不正确的是
作电极的氢氧燃料电池工作时的说法不正确的是
A. 当用碱性电解质时,负极的反应是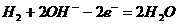
B. 当用酸性或碱性电解质时,负极附近溶液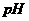 都会降低
都会降低
C. 当用酸性或碱性电解质时,电池总反应都是
D.
当用酸性电解质时,正极的反应是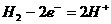
13.下列离子方程式书写错误的是 A.明矾溶液与足量的氢氧化钡溶液混合 Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
B.足量的氢氧化钠溶液加入到碳酸氢钙溶液中
Ca2++HCO3-+OH-=CaCO3↓+2H2O
C.石灰乳与碳酸氢铵浓溶液混合加热
Ca(OH)2+NH4++HCO3-  CaCO3+NH3↑+2H2O
D.Fe2O3溶于过量的氢碘酸中 :Fe2O3+6H++6I-=2Fe2++3I2+3H2O
CaCO3+NH3↑+2H2O
D.Fe2O3溶于过量的氢碘酸中 :Fe2O3+6H++6I-=2Fe2++3I2+3H2O
12.在Fe3+、Cu2+、Fe2+物质的量之比为6∶4∶1的混合液中加入适量的Fe粉充分反应后,上述溶液中三者物质的量之比改变为4∶6∶9,则参加反应的铁粉与原溶液中Fe3+的物质的量之比为
A.1:4 B.3:7 C.5:18 D.1:2
11.一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中 , 再用0.1mol/L NaOH溶液进行中和,则所需NaOH溶液的体积为:
A. 大于20mL B. 小于20mL C. 等于20mL D. 等于5mL
9. 某难溶物X,溶于稀硝酸得溶液Y,将Y与过量NaOH反应得沉淀乙,加热乙又转变为X,则X可能为 A、FeO B、Fe2O3 C、Al2O3 D、CaCO3
10常温下某溶液中由水电离产生的c(OH-)、c(H+)满足c(OH-)·c(H+)=10-26下列各组离子在溶液中一定能大量共存的是 A.Fe2+、NO3-、Al3+、Cl- B.Mg2+、SO42-、Na+、HCO3- C.Ba2+、NO3-、K+、Cl- D.K+、NH4+、AlO2-、CO32-
8.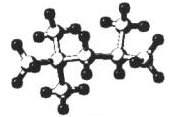 .“辛烷值"用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,以下是异辛烷的球棍模型,则异辛烷的系统命名为
A 1,1,3,3-四甲基丁烷 B 2,2,4-三甲基-戊烷
C 2,4,4-三甲基戊烷 D 2,2,4-三甲基戊烷
.“辛烷值"用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,以下是异辛烷的球棍模型,则异辛烷的系统命名为
A 1,1,3,3-四甲基丁烷 B 2,2,4-三甲基-戊烷
C 2,4,4-三甲基戊烷 D 2,2,4-三甲基戊烷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com