
题目列表(包括答案和解析)
21.某物质的溶解度s随温度变化的关系如图所示,现在60℃时的100克水中制成该物质的饱和溶液,当降温至30℃时,析出晶体后所得溶液质量为

A.130克 B.140克
C.160克 D.180克
20.与纯水的电离相似,液氨中存在着微弱的电离:2NH3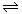 NH4++NH2-。据此判断以下叙述中错误的是
NH4++NH2-。据此判断以下叙述中错误的是
A.液氨中含有NH3、NH4+、NH2-等粒子
B.一定温度下液氨中c(NH4+)、 c(NH2-)是一个常数
C.液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
19.等物质的量浓度、等体积的氢氧化钠溶液和乙酸溶液混合后,混合液中有关离子物质的量浓度之间一定存在的关系是
A.[Na+]+[H+]=[CH3COO-]+[OH-]
B.[Na+]=[CH3COO-]+[H+]
C.[Na+]>[CH3COO-]> [H+]> [OH-]
D.[Na+]>[OH-]>[CH3COO-]> [H+]
18.下列离子方程式书写正确的是
A.铁跟稀硫酸反应:2Fe + 6H+ → 2Fe3+ + 3H2↑
B.碳酸钙跟稀盐酸反应:CaCO3+2H+ →Ca2++CO2↑+H2O
C.醋酸溶液跟氢氧化钠溶液反应:H+ + OH-→ H2O
D.NaHS水解:HS- + H2O → H3O+ + S2-
17.体积相同、pH相同的盐酸和醋酸,与碱中和时消耗的量
A.相同 B.盐酸多 C.醋酸多 D.无法比较
16.向纯水中加入少量NaHSO4(温度不变),则溶液的
A.pH值升高 B.pH值降低
C.c(OH-)、 c(H+)都增大 D.pH值不变
15.下列说法中正确的是
A.在25℃的纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性
B.溶液中若c(H+)>10-7 mol/L,则溶液一定呈显酸性
C.c(H+)越大,则pH值越大,溶液的碱性越强
D.pH值为0的溶液,其中只有H+,而无OH-
14.下列叙述错误的是
A.具有相同的电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期
B.第1-3周期是短周期,第4-6周期是长周期,第7周期是不完全周期。
C.每一周期的元素都是从最外层电子数为1的碱金属开始,逐渐过渡到最外层电子数为7的卤素,最后以稀有气体元素结束
D.同周期元素(除稀有气体外)从左到右,元素的金属性逐渐减弱,非金属性逐渐增强
13.下列各组性质的比较中,不正确的是
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.原子半径:Cl>S D.金属性:K>Na
12.现有20℃时饱和食盐水200克,在以下操作中能改变其溶解度的是
A.恒温蒸发掉5克水 B.在温度不变时加入10克氯化钠
C.用玻璃棒搅拌 D.升高温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com