
题目列表(包括答案和解析)
2. 不粘锅是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯。洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯。关于聚四氟乙烯和四氯乙烯,下面的说法正确的是
不粘锅是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯。洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯。关于聚四氟乙烯和四氯乙烯,下面的说法正确的是
 A.它们都是乙烯的同系物
B.它们都属于混合物
A.它们都是乙烯的同系物
B.它们都属于混合物
 C.它们的分子中都含有C=C双键 D.它们分子中都不含氢原子
C.它们的分子中都含有C=C双键 D.它们分子中都不含氢原子
1. 下列各组物质中,全部属于纯净物的是
下列各组物质中,全部属于纯净物的是
 A.福尔马林、白酒、食醋 B.汽油、酒精、聚乙烯
A.福尔马林、白酒、食醋 B.汽油、酒精、聚乙烯
 C.石炭酸、盐酸、冰醋酸 D.甘油、乙醇钠、氯仿
C.石炭酸、盐酸、冰醋酸 D.甘油、乙醇钠、氯仿
33.(10分)近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水。请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是① ,②
;
 (2)由乳酸和甲醇可以制取
(2)由乳酸和甲醇可以制取  ,请写出设计合成实验时所涉及的有机反应类型
、
、
。
(3)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料
,请写出设计合成实验时所涉及的有机反应类型
、
、
。
(3)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料 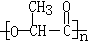 ,它是由乳酸通过
反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式
,它是由乳酸通过
反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式
。 (4)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性。乳酸分子是手性分子,乳酸[③CH3②CH(OH)①COOH]的手性碳原子是( )号碳原子。 (5)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1 mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子。
写出该物质的结构简式 。
32.(6分)下图中A、B、C、D四条曲线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线 ;表示ⅣA族元素气态氢化物沸点的是曲线 ;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是
。

31.(7分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。

①(2分)同主族内不同元素的E值变化的特点是:
。
各主族中E值的这种变化特点体现了元素性质的 变化规律。
②(2分)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系中正确的是 (填写编号,多选倒扣)
① E(砷)>E(硒) ② E(砷)<E(硒)
③ E(溴)>E(硒) ④ E(溴)<E(硒)
③(2分)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
____ _________<E<
④(1分)10号元素E值较大的原因是
。
30.(11分)在白磷分子中,每个磷原子以________________键与另外的________个磷原子相结合成__________________空间构型,键角为________ ___,分子为
分子(填极性或非极性), 于CS2中(填易溶或难溶)。如果把一个白磷分子的每一个P-P都打开插入一个氧原子,则一共可结合________个氧原子,这样得到的化合物的分子式为__________,若每个磷原子再以配位键结合一个氧原子,则得到化合物的分子式为_____ __ ___。形成的配位键中,________原子提供孤对电子,_________原子提供空轨道。
29.(10分)X、Y、Z三种常见的短周期元素可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)(6分)写出X、Y、Z三种元素的符号和名称:
X ;Y ;Z
(2)(2分)分析Z2Y2中含有的化学键类型: ;
(3)(1分)写出Z2Y2与二氧化碳反应的方程式:
(4)(1分)表示出X和Z两元素形成的化合物的电子式: 。
28.下列说法不正确的是
A.原子间通过共用电子所形成的化学键叫做共价键
B.成键原子间原子轨道重叠愈多,共价键愈牢固
C.对双原子分子来说,键能愈大,含有该键的分子愈稳定
D.键长愈长,化学键愈牢固
第Ⅱ卷(共44分)
27.常温下三氯化氮(NCl3)是一种淡黄色液体。以下关于NCl3的说法中,正确的是
A.分子中N-Cl键是非极性键
B.分子中不存在孤对电子
C.三氯化氮分子结构呈三角锥形
D.因N-Cl键键能大,它的沸点高
26.下列各原子序数所表示的两种元素,能形成AB2型离子化合物的是
A.6和8 B.11和13 C.11和16 D.12和17
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com