
题目列表(包括答案和解析)
23.某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度<计算出结果到小数点后二位)________mol/L
22.(12分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)
__ __ 。
A.9 B.13 C.11-13之间 D.9-11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系
c(NH4+) c(Cl-)。
21.(12分)按要求书写
(1)氢氧化铝的酸式电离方程式:
氢氧化铝的碱式电离方程式:
(2)用离子方程式表示明矾净水原理:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,离子反应总方程式为:
向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
20.下列溶液中有关物质的量浓度关系正确的是( )
A.pH = 2的HA溶液与pH = 12的MOH溶液任意比混合:
c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) + 2c(OH-) = 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH = 4:c(HA-) > c(H+) > c(H2A) > c(A2-)
19.可逆反应aA(g) + bB(g) cC(g) + dD(g)符合下图。则下列叙述正确的是( )
cC(g) + dD(g)符合下图。则下列叙述正确的是( )


A.a+b < c+d;正反应吸热 B.a+b > c+d;正反应放热
C.a+b < c+d;正反应放热 D.a+b > c+d;正反应吸热
18.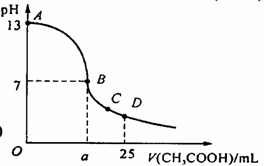 在25
mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
在25
mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
A.在A、B间任一点,溶液中一定都有
c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
B.在B点,a > 12.5,且有
c(Na+) = c(CH3COO-) = c(OH-) = c(H+)
C.在C点:c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
17.已一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在同温同压下,向两个相同的容积可变的密闭容器中分别通入1molN2、4molH2 和0.5molN2、2molH2,
在同温同压条件下达到平衡,分别放出热量Q1kJ和Q2kJ,则下列关系正确的是( )
A.2Q2 = Q1 = 92.4 B.2Q2 < Q1 < 92.4
C.2Q2 = Q1 < 92.4 D.Q2 = Q1 < 92.4
16.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量相等的锌粒,反应结束后,两烧杯中得到等量的氢气。下列说法正确的是
A.甲烧杯中的锌粒有剩余
B.乙烧杯中的酸全部反应
C.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
D.两烧杯中参加反应的锌的质量相等
15.某密闭容器中发生如下反应:X(g) + 3Y(g) 2Z(g);ΔH < 0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH < 0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
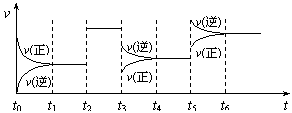 A.t2时加入了催化剂
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4-t5时间内反应物的转化率最低
14.将0.1mol·L-1某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.HA是强酸 B.c(Na+) > c(A-)
C.c(HA) + c(H+) = c(OH-) D.c(HA) + c(A-) = 0.1mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com