
题目列表(包括答案和解析)
25、某同学为了探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。
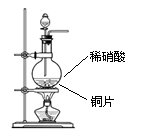

A B C D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接______。
(2)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:____________________________________。在实验过程中,该同学采用了微热的方法,目的是_________________________________。
(3)实验开始时,该同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:________________________________________。
24、铁和铝是两种重要的常见金属。请回答: (1)将烧得红热的铁丝伸入盛有氯气的集气瓶中,可观察到有棕黄色的烟生成。
该反应的化学方程式为_____________________。 (2)常温下,将铁、铝放入浓硝酸中,可发生钝化现象,是由于浓硝酸具有____性。 (3)铝热反应原理可用于焊接钢轨,写出铝与氧化铁高温下反应的方程式________。 三、实验题(每空2分,本大题共16分)
23、市售气体打火机中的气体主要成份是丁烷,正丁烷的结构简式为___________,它的同分异构体的结构简式为____________,该同分异构体的名称(用系统命名法)为__________。
22、红热的铁与水蒸气可发生反应: 3Fe + 4H2O(g)△Fe3O4 + 4H2,其中,作为氧化剂的物质是_________(填化学式),作为还原剂的物质是_________(填化学式)。在该反应中,若消耗了84g Fe,则生成______mol H2。
21、在A、氯化钾,B、醋酸钠,C、氯化铵三种盐溶液中,常温下⑴溶液呈酸性的是______(填字母,下同),⑵溶液呈中性的是_______,⑶溶液呈碱性的是______
20、冶炼金属常用以下几种方法:① 热分解法;② 热还原法;③ 电解法 请将适宜冶炼以下金属的方法的标号填写在该金属后面的横线上。
⑴铝______________⑵铁_____________⑶汞______________
19、在高温下,下列反应达到平衡:C ( s ) + H2O ( g
) CO
( g ) + H2 ( g ) (正反应为吸热反应)。如果升高温度,平衡将向__________方向移动(填“正反应”或“逆反应”,下同);如果增大压强,平衡将向_______方向移动,如果增大水蒸气的浓度,平衡将向_______方向移动。
CO
( g ) + H2 ( g ) (正反应为吸热反应)。如果升高温度,平衡将向__________方向移动(填“正反应”或“逆反应”,下同);如果增大压强,平衡将向_______方向移动,如果增大水蒸气的浓度,平衡将向_______方向移动。
18、1mol CH4与Cl2反应生成CCl4,所需Cl2的物质的量为
A、1mol B、2mol C、3mol D、4mol
17、下列各组物质中互为同系物的是
A、金刚石与石墨 B、氕、氘、氚
C、甲烷与十三烷 D、2-甲基丁烷与异戊烷
16、为了除去镀在铝表面的铜镀层,可选用的试剂是
A、浓硝酸 B、浓硫酸 C、王水 D、稀硝酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com