
题目列表(包括答案和解析)
19.现有CuSO4和Fe2(SO4)3的混合溶液100mL,已知溶液中金属阳离子的浓度相同(不考虑离子的水解),且c(SO42- )=5mol/L,则此溶液最多可溶解铁粉的质量是
A.5.6 g B,11.2 g C.16.8 g D.22.4g
18.1克镁铝合金投入到500 mL2 mol/L的盐酸中完全溶解后,加入4 mol/L的烧碱溶液,当得到的沉淀最多时,加入烧碱溶液的体积是
A.500 mL B.350 mL C.300 mL D.250 mL
17.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是
A c(OH-)>c(HA)>c(HB)>c(H+) B c(OH一)>c(A一)>c(B-)>C(H+)
C.c(OH一)>c(B一)>c(A一)>c(14+)D.c(OH一)>c(HB)>c(HA)>c(H+)
16.常温下,小苏打水溶液pH>7,则关于小苏打水溶液的表述正确的是
A.HCO3-的电离程度大于HCO3-的水解程度
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32_)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
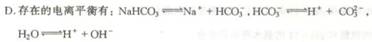
15.下列实验方法正确的是
A.除去CO2中少量O2:通过灼热的镁网后收集气体
B.除去A13+溶液中的少量Fe3+:加入过量氨水
C.配制FeCl3溶液:将FeCl3固体溶解于水中
D.除去FeCl3酸性溶液中少量的FeCl2;加入稍过量双氧水后放置
13.在一支25 mL的酸式滴定管中盛入O.1 mol/L HCl溶液,其液面恰好在5 mL的刻度处。若把滴定管中的溶液全部放入烧杯中,然后用O.1 mol/L Na0H溶液进行中和,则所需NaOH溶液的体积
A.大于20mL B.小于20mL C.等于20mL D.等于5mL。
14,据报道,我国拥有完全自主产权的氢氧燃料电池车在-北京奥运会期间为运动员提供服务某种氢氧燃料电池的电解质溶液为KOH溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.该电池反应消耗2.24 LH2(标准状况)时,有0.1mol电子转移
12.在pH都等于9的NaOH和CH3COONa 两种溶液中,设由水电离产生的0H一浓度分别为A mol·L-1‘与B mol-1,,则A和B的关系为
A.A>B B.A<B C A=B D.无法确定
11.室温时下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
10.在盛有稀H:sO。的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
A.正极附近的SO42-浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
9.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 mol Fe与足量Cl2反应,转移的电子数为2 NA
B.1L浓度为1 mol/L的Na2CO3溶液中含有NA个CO32-
C.铝跟氢氧化钠溶液反应生成1 mol H2时,转移的电子数为2NA
D.常温常压下的33.6 L Cl2与27 g A1充分反应,转移电子数为3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com