
题目列表(包括答案和解析)
3、100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:
C(s)+1/2O2(g)=CO (g);△H=-110.35kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量为( ) A、39.292kJ B、3274.3kJ C、784.92kJ D、2489.44 kJ
2、用惰性电极实现电解,下列说法正确的是( )
A、电解氢氧化钠溶液,要消耗OH-,故溶液pH减小
B、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
1、下列各变化中属于原电池反应的是( )
A、在空气中金属铝表面迅速氧化形成保护层
B、镀锌铁表面有划损时,也能阻止铁被氧化
C、红热的铁丝与冷水接触,表面形成蓝黑色保护层
D、浓硝酸比稀硝酸更能氧化金属铜
25 (5分)恒温条件下将2.0 molSO2与a mol O2混合通入一密闭容器中,发生如下反
应:2SO2(g)+O2(g)==2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3 mol,n(O2)=3.0 mol。
求:(1)a的值。
(2)平衡时SO2的转化率。
26 (7分)5.6 g镁、铜的混合物投入到100mLl0mol/L的硝酸溶液中,充分反应后金属
无剩余,产生气体4.48 L(标准状况下)。若将该混合气体与1.68LO2共同通入水中能
被完全吸收。计算:
(1)镁的质量。
24.(12分)用如图所给仪器可完成下列实验(铁架台、胶塞及其它辅助设备从略)。
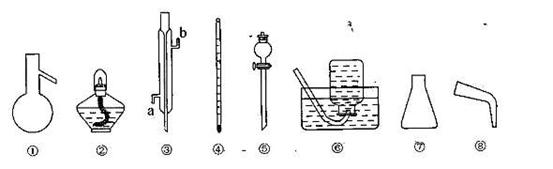
(1)完成制取并收集乙烯的实验,需要用到的仪器有 (填
序号,下同);酒精和浓硫酸混合时应先向容器中加入
(2)完成制取并收集乙炔的实验,需要用到的仪器有 :减
缓产生乙炔的速率,分液漏斗中可盛装 。
(3)完成石油的蒸馏实验时,温度计水银球应处丁 仪器
③在使用时应从 口进水。
23.(7分)现有常温下的四份溶液:①0.0lmol/L CH3COOH;②0.01mol/L HCl 3pH=12
的氨水;④pH=12的NaOH溶液。
(1)水的电离程度最大的是 。
(2)将①、④等体积混合,所得混合液显 性,其原因是
(用离子方程式表示)
(3)将四份溶液稀释相同倍数后,溶液的pH由大到小的顺序是 。
22.(5分)下图为氢氧燃料电池的示意图:
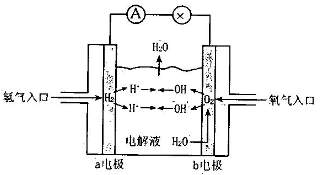
(I)若以稀硫酸为电解液,则a极为 极。
(2)若以KOH溶液作电解液,则b极上的电极反应式为 ,
放电一段时间后电解液的pH将 (填“变人”、“变小”或“不变”)。
21.(8分)A、B是日常生活中两种常见的金属单质,其余均为化合物,其中C、E、F
均含B元素,D、G、H、J均含A元素。己知F在空气中会迅速变成灰绿色,最后
变成红褐色.将红褐色物质灼烧,产生C。试同答:(转化关系中部分产物已略去)
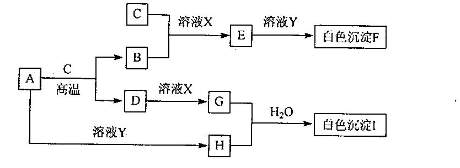
(1)X可能是 。
a.盐酸 b.稀硫酸 c.NaOH d.氨水
(2)完成下列反应的方程式:
A和C反应的化学方程式 。
A和溶液Y反应的离子方程式
(3)n(B)、n(c)应满足的关系是 。
20.(6分)现有FeCl3、CuCl2的混合液,在该混合溶液中加入铁粉和铜粉的混合物。
(I)充分反应后,若有固体剩余,则溶液中一定含有的金属离子是 ,一定不含有的金属离子是 ,可能含有的金属离子是 。
(2)充分反应后,若无固体剩余,则Cu参与反应的离子方程式为
,CuCl2是否参加了反应 (填“是”或“否”)
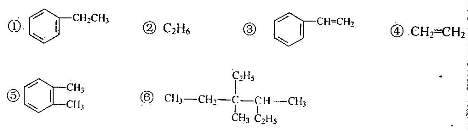
19.(6分)F列物质中,互为同系物的是 ,互为同分异构体的
是 能使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色的
是 。(填入括号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com