
题目列表(包括答案和解析)
23、(9分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如右表所示:
|
金属 |
电子流动方向 |
电压/V |
|
Fe |
Fe → Cu |
+0.78 |
|
Zn |
Zn → Cu |
+1.10 |
|
A |
Cu → A |
-0.15 |
|
B |
B → Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 (填“大”、“小”)。Zn、A、B三种金属活动性由强到弱的顺序是 。
(2)Cu与A组成的原电池, 为负极,此电极反应式为 。
(3)A、B形成的合金露置在潮湿空气中, 先被腐蚀。
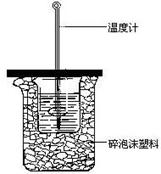
22、(6分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液(密度都是1g·cm-3)在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中缺少的一种实验用品是 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(填“偏大、偏小、无影响”)
(4)若已知反应后测得溶液温度升高了3.4 K,且已知中和后生成的溶液的比热容为4.18J·g-1·K-1,则可计算出该实验反应放出的总热量为___________J。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
21、(10分)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:
(1)铁锅的锈蚀应属于______________,腐蚀的原因是_______________________。
(2)铁锅锈蚀的电极反应式为:正极 ,
负极 。正负电极反应产物会继续发生反应,反应的化学方程式为
 、
、
20、(4分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式
____________________________________________________________________
19、(5分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
18.可逆反应:A(g)+B C(g)+D 中,A与C都是无色气体,当达到平衡时,下列叙述错误的是( )
C(g)+D 中,A与C都是无色气体,当达到平衡时,下列叙述错误的是( )
A、若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B、增大压强,平衡不移动,说明B、D必是气体
C、升温,C的百分含量减少,说明正反应是放热反应
D、若B是气体,增大A的浓度会使B的转化率增大
荣成市第六中学2008-2009学年度第二学期第一次模块质量检测
高二年级化学试题
第Ⅱ卷(非选择题,共46分)
17、下列关于化学反应的自发性叙述中正确的是( )
A、焓变小于0,而熵变大于0的反应肯定是自发的
B、焓变和熵变都小于0的反应肯定是自发的
C、焓变和熵变都大于0的反应肯定是自发的
D、熵变小于0,而焓变大于0的反应肯定是自发的
16、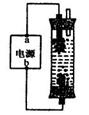 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A、a为正极,b为负极;NaClO和NaCl
B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl
D、a为阴极,b为阳极;HClO和NaCl
15、下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A、① B、④ C、②③④ D、①②③
14、氢气在氯气中燃烧的反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是 ( )
A、Q1+Q2>Q3 B、Q1+ Q2>2Q3 C、Q1+Q2<Q3 D、Q1+ Q2<2Q3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com