
题目列表(包括答案和解析)
21.(7分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
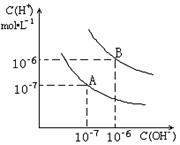
(1)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的
pH=7,则NaOH溶液与溶液的体积比为 。
(2)95时,若pH=a的某强酸溶液与pH=b的某强碱溶液等体积混合后溶液呈中性,则a与b应满足的关系是 。
(3)曲线B对应温度下,pH=2的某酸HA溶液和pH=10的NaOH 溶液等体积混合后,混合溶液的pH=5。请分析其原因:
20.(8分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④含0.1molNH3·H2O和0.1molNH4Cl的混合液1L ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞。
(2)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)。
(3)在溶液④中, 离子的浓度为0.1mol/L;c (NH3·H2O)和c(NH4+)之和为 mol/L。
(4)若溶液②的pH=7,则c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)。
19.(9分)
(1)现有0.1mol·L-1的纯碱溶液,其溶液呈 性,原因是(用离子方程表示) 。
(2)欲使0.1mol·L-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 。
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是 。
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
(4)为探究纯碱溶液呈碱性是由CO32-引起的,请你用纯碱溶液、酚酞、氯化钙溶液做试剂设计一个简单的实验方案 。
(5)有资料记载:常温下,0.1mol·L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的10%。请你用pH试纸设计实验验证之 。
18.已知25℃时,AgI的饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/Lmol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
胶南市2008-2009学年度第一学期期末教学质量统一检测
高二化学(理)试题
第Ⅱ卷(非选择题,46分)
17.要将pH=1体积为a mL的盐酸变为pH=2(近似认为不同浓度的盐酸密度相同),下列采取的措施能够达到预期目的的是
A.加热蒸发到溶液体积为0.5a mL B.加入a mL蒸馏水
C.加入10a mL的pH=3的盐酸 D.加入0.5a mL与盐酸相同浓度的NaOH溶液
16.下列过程或现象与盐类水解无关的是
A.纯碱溶液加热可增加去污效果 B.铁片在潮湿的环境下表面形成红棕色水膜
C.加热氯化铁溶液颜色变深 D.NaHCO3溶液遇酚酞试剂呈粉红色
15.要使0.1 mol/L的醋酸溶液中c(H+)/c(CH3COOH)值增大,pH增大,可采取的措施是
A.加少量CH3COONa固体 B.升高温度 C.加少量冰醋酸 D.加水
14.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO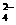 )>c(NH
)>c(NH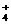 ))>c(Cu2+)>c(H+)>c(OH-)
))>c(Cu2+)>c(H+)>c(OH-)
C.将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:c(NH4+)=2c(SO42-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
13.下列各组离子不可能大量共存的是
A.能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO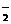
B.能与金属铝反应放出氢气的溶液中: K+、SO42-、Cl-、NH
C.250C时,某溶液中由水电离出的c(OH-)=1×10-13 mol/L:
NH4+ 、Fe3+ 、SO42- 、Cl-
D.含有HCO3-的溶液中:K+、OH-、NO 、Ca2+
、Ca2+
12.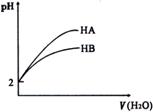 pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如右图所示。则下列叙述正确的是
pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如右图所示。则下列叙述正确的是
A.电离平衡常数HA>HB
B.等体积的HA和HB与等浓度的NaOH反应,HA消
耗的NaOH多
C.等体积的HA和HB与等质量的Zn反应,HA平均反应速率大
D.若有等浓度的NaA、NaB,则碱性NaA>NaB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com