
题目列表(包括答案和解析)
6.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)  C(g)
+D(g)
C(g)
+D(g)  H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
A.降低温度 B.恒容时,再通入2amolC和2amolD
C.恒压时,再通入2amolC和2amolD D.恒容时,再通入amolA和amolB
5.已知:在一定温度下,H2(g)+ I2(g) 2 HI(g)的平衡常数为K1;1/2H2(g)+ 1/2I2(g)
2 HI(g)的平衡常数为K1;1/2H2(g)+ 1/2I2(g) HI(g)的平衡常数为K2,则K1、K2的关系为
HI(g)的平衡常数为K2,则K1、K2的关系为
A.K1=K2 B.K1=2K2 C.K1=K22 D.K1=1/2K2
4.已知4NH3(g)+5O2(g)= 4NO(g)+6H2O(g),若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系是
A.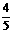 υ(NH3)=υ(O2)
B.
υ(NH3)=υ(O2)
B. 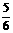 υ(O2)=υ(H2O)
υ(O2)=υ(H2O)
C.  υ(NH3)=υ(H2O)
D.
υ(NH3)=υ(H2O)
D.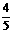 υ(O2)=υ(NO)
υ(O2)=υ(NO)
3.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应 B. 该反应是放热反应
C. 铁粉和硫粉在常温下容易发生反应 D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
2. 有关下列能量转化的认识不正确的是
A.植物的光合作用使得太阳能转化为了化学能
B.电解水生成氢气和氧气时,电能转化为化学能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理有效
D.白炽灯工作时将电能全部转化为光能
1.热化学反应方程式中物质前的化学计量数表示
A.分子数 B.原子个数 C.物质的质量 D. 物质的量
32.态烃含C85.7%,含H14.3%,在标准状况下的密度是2.5g/L。该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
31.同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过浓硫酸和碱石灰,两者分别增重0.144 g和0.528 g,生成物完全被吸收。试回答以下问题:
维生素C中碳的质量分数是____ _,氢的质量分数____________
维生素中是否含有氧元素?为什么?(试通过计算说明)
如果需要你确定维生素C的分子式,你还需要哪些信息?
30.学们根据官能团的不同对下列有机物进行分类。

(1)芳香烃: (2)卤代烃: (3)醇: (4)酚:
(5)醛: (6)酮: (7)羧酸: (8)酯:
29.实验室用右图所示的装置制取乙酸乙酯。
(1)在大试管中先加乙醇和乙酸后加浓硫酸,然后轻轻振荡试管,使之混合均匀加热。此反应的化学方程式
 (2)装置中通蒸气的导管要插到饱和碳酸钠溶液液面上, 而不能插入液面中,原因是:
。
(2)装置中通蒸气的导管要插到饱和碳酸钠溶液液面上, 而不能插入液面中,原因是:
。
(3)饱和碳酸钠溶液的作用是
① ;
② ;
③ 。
(4)浓硫酸的作用是:
(5)实验制取的乙酸乙酯,其密度比水_____,有_______气味。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com