
题目列表(包括答案和解析)
15.下列事实,不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O  HBr+HBrO
,当加入NaOH溶液后颜色变浅
HBr+HBrO
,当加入NaOH溶液后颜色变浅
B.对2HI H2+I2(g)
,平衡体系增加压强使颜色变深
H2+I2(g)
,平衡体系增加压强使颜色变深
C.反应CO+NO2 CO2+NO △H <0, 升高温度使平衡向逆向移动
CO2+NO △H <0, 升高温度使平衡向逆向移动
D.合成氨反应:N2+3H2 2NH3 △H <0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 △H <0,为使氨的产率提高,理论上应采取低温高压的措施
14.把Ca(OH)2放入一定量的蒸馏水中,一定温度下达到平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq),当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数目减少 B.Ca2+浓度增大
C.溶液pH减小 D.溶液pH增大
13.若溶液中由水电离产生的c (OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定不能大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- HCO3- D.K+ Fe3+ SO42- NO3-
12.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L氢氰酸溶液的pH约为3 B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的导电性弱
11.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A>B B. A=10-4 B C. B=10-4 A D.A=B
10.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
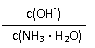
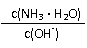
A. B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
9.下列关于原电池的叙述正确的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池放电时,电流的方向是从负极到正极
C.原电池工作时,溶液中的阳离子向负极移动
D.原电池是化学能转变为电能的装置
8.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88 kJ B.吸热44 kJ C.放热44 kJ D.吸热2.44 kJ
7.已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
A.+184.6 kJ·mol-1 B.―92.3 kJ·mol-1
C.―369.2 kJ·mol-1 D. +92.3 kJ·mol-1
6.四个试管中都装有
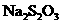 溶液,分别在不同温度下加入
溶液,分别在不同温度下加入 稀硫酸和一定量水,最先出现浑浊的是
稀硫酸和一定量水,最先出现浑浊的是
A.20℃,10 mL硫酸 B.20℃,5 mL硫酸,5 mL水
C.40℃,5 mL硫酸,2 mL水 D.40℃,4 mL硫酸,3 mL水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com