
题目列表(包括答案和解析)
5.下列电离方程式中,正确的是
A.CH3COOH=CH3COO- + H+ B.H2SO3 2H+
+SO32-
2H+
+SO32-
C.HCO3-+H2O H3O+
+CO32- D.Na2CO3
H3O+
+CO32- D.Na2CO3 2Na+
+ CO32-
2Na+
+ CO32-
4.对于可逆反应:N2
+3H2 2NH3(正反应为放热反应),下列说法中正确的是
2NH3(正反应为放热反应),下列说法中正确的是
A.反应达到平衡时,各物质的浓度不再发生变化
B.反应达到平衡时,各物质的浓度都相等
C.反应达到平衡时,各物质的浓度之比为1:2:3
D.降低温度时,反应的正反应速率增大,而逆反应速率减小
3.下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2 N2O4
(正反应为放热反应)
N2O4
(正反应为放热反应)
B.3O2 2O3 (正反应为吸热反应)
2O3 (正反应为吸热反应)
C.H2(g) + I2(g) 2HI(g)
(正反应为放热反应)
2HI(g)
(正反应为放热反应)
D.NH4HCO3(S) NH3(g) + H2O(g)+CO2(g)
(正反应为吸热反应)
NH3(g) + H2O(g)+CO2(g)
(正反应为吸热反应)
2.下列物质中属于电解质的是
A.饱和食盐水 B.氯气 C.硫酸钡 D.酒精
1.下列各组物质中,互为同素异形体的是
A. 126 C和146 C B.红磷和白磷
C.氯水和液氯 D.烧碱和火碱
30.(14分)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)450℃时,将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中反应,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L,放出3.932KJ的热量,则该条件下反应的平衡常数K为 ;升高温度,该平衡常数 (填“增大”或“减小”)。
(2)SO2的平衡转化率为 ;
写出该反应的热化学方程式 。
(3)该反应处于平衡状态时,在容器体积仍为1 L的条件下,下列措施有利于提高SO2平衡转化率的 (填字母)
A、升高温度 B、降低温度 C、缩小体积
D、增大体积 E、加入催化剂 F、移出氧气
(4)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为_________________________ ______________。
(5)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。加入铁粉的离子方程式为_______________________________________________。
29.实验题(共9分)
(Ⅰ)(3分)某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
E.用浓度分别为0.50mol/L ,体积各为50mL盐酸、氢氧化钠溶液测定中和热
(Ⅱ)(6分)
用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
|
|
NaOH起始读数 |
NaOH终点读数 |
|
第一次 |
0.10mL |
18.40mL |
|
第二次 |
0.30mL |
18.40mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1 (小数点后保留两位有效数字)。
(2)判断滴定终点的现象是 。
(3)以下操作造成测定结果偏高的原因可能是 (填写序号)。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
28.(12分)
已知电极材料:铁、铜、银、石墨、锌、铝;
电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。接要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用。请用电化学知识说明原因 。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?
(填“能”或“不能”),若能,请写出电极反应式,负极 ,
 正极
。
正极
。
③若发生如下反应:Cu+2H+= Cu2++H2↑,请在右边框图内画出实现该反应的装置图(使用题目所给材料和药品)。

④若用石墨作电极,电解0.1mol/L盐酸 1 L,转移0.5mol电子时,阳极得到气体体积(标况)为 L。
27.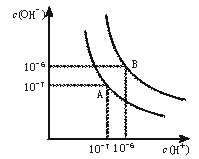 (8分)水的电离平衡曲线如下图所示。
(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加 。
(2)将100℃ 、pH=8的Ba(OH)2溶液与相同温度下pH=5的稀盐酸混合,并保持恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
26.填空:(7分)
(1)氯化铝水溶液呈 (填“酸”、“中”或“碱”)性 ,原因是(用离子方程式表示):_____________________ _____________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的固体产物是 (填“化学式”)。
(2)在配制硫化钠溶液时,为了抑制水解,可以加入少量的 (填化学式);其水解的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com