
题目列表(包括答案和解析)
20. 右图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
右图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
A.电解一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色B.蛋壳表面缠绕的铁丝发生氧化反应。
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝。
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触.
19.现已知:2H2(g)+O2(g)=2H2O(l),⊿H=-572kJ/mol;H-H键的键能为436kJ/mol;O=O键的键能为498kJ/mol,则H2O分子中O-H键的键能为( )
A.485.5 kJ/mol B.610 kJ/mol C.917 kJ/mol D.1220 kJ/mol
18.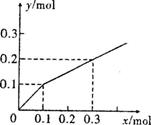 以Pt为电极,电解含有0.10mol
M+和0.10mol N3+
(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
以Pt为电极,电解含有0.10mol
M+和0.10mol N3+
(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
A.M+ > H+ > N3+
B.M+ >N3+ > H+
C.N3+ >H+ > M+
D.条件不足,无法确定
17.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )


A.该能量转化系统中的水也是可以循环利用的
B.燃料电池系统产生的能量实际上来自于太阳能
C.水电解系统中的阳极反应:4OH--4e - =2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e -=2H+
16.醋酸溶液中存在电离平衡CH3COOH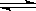 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.升高温度,醋酸溶液的pH值变小
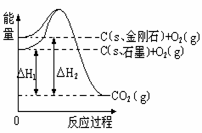
15.如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)== C(s、金刚石)
△H=
+1.9 kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1
mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
14.用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
A.通甲烷的一极为负极,通氧气的一极为正极
B.放电时通入氧气的一极附近溶液的pH升高
C.放电一段时间后,KOH的物质的量会发生变化
 D.通甲烷的电极反应式是:CH4+10OH-+8e-==CO32-+7H2O
D.通甲烷的电极反应式是:CH4+10OH-+8e-==CO32-+7H2O
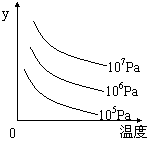
13.某可逆反应L (s)+G(g)  3R(g);ΔH>0。右图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g);ΔH>0。右图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
12.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
 D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D.电解后,电解槽底部的阳极泥中只有Cu和Pt 
11.一定温度下,某密闭容器里发生如下反应:CO(g) + H2O(g) CO2(g)
+ H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是( )。
CO2(g)
+ H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是( )。
 ①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2
①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2 
 ④再加入2n mol CO和2n mol H2O(g)
④再加入2n mol CO和2n mol H2O(g)
 A.①② B.②④ C.③④ D.①②③
A.①② B.②④ C.③④ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com