
题目列表(包括答案和解析)
2.2008年夏季奥运会突出了“绿色奥运、科技奥运、人文奥运”理念。绿色奥运是指
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛
B.严禁使用兴奋剂,使运动员公平竞争
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
求。
1.三聚氰胺(C3N6H6)可以看成是三聚氰酸C3N3(OH)3中的-OH被-NH2取代的产物。下列有关推断正确的是
A. 三聚氰胺是一种不饱和烃
B.奶粉中掺入三聚氰胺能提高氮的含量
C. 奶粉中掺入三聚氰胺能提高蛋白质的含量 D.三聚氰酸与三聚氰胺是同分异构体
29. 如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)错误!不能通过编辑域代码创建对象。Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)错误!不能通过编辑域代码创建对象。Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:
n(W)A n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是
28.向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(气)+ 3 H2(气) 2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c= .
(2)若a=0.7,b=2.1,则:
Ⅰ.c= .
Ⅱ.这时反应向 进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是 .
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是 .
27.工业制硫酸的核心反应是 :2SO2(g)+ O2(g)错误!不能通过编辑域代码创建对象。2SO3(g) ΔH<0,回答下列问题:
(1)此反应的平衡常数表达式为K=_______________,随着温度的升高,上述平衡常数_______(填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1 L密闭容器中,在一定条件下达到平衡,测得SO2为0.11 mol,O2为0.05 mol,SO3为0.12 mol。计算该条件下,SO2转化为SO3转化率=_________。(结果保留一位小数)
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是_____________(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可用氨水吸收。
反应的化学方程式为________________________________。
26.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
 ① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
⑴Z2Y的化学式是 ,
⑵Z2Y2与X2Y反应的化学方程式是 。
⑶如图所示装置,两玻璃管中盛满滴有酚酞的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
C(Ⅱ)的电极反应式是 。
⑷铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
25.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ
(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH
 溶液。肼-空气燃料电池放电时:
溶液。肼-空气燃料电池放电时:
正极的电极反应式是
(3)右图是一个电化学过程示意图。
假设使用肼-空气燃料电池作为本过程中的电源,铜
片的质量变化为128g,则肼-空气燃料电池理论上消
耗标准状况下的空气 L(假设空气中氧气体
积含量为20%)
24.
一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生反应:X(气)+Y(气)  mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ 2的关系为( )
mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ 2的关系为( )
A.φ1>φ2 B.φ1<φ2 C.φ1=φ2 D.无法判断
23.在一个固定体积的密闭容器中,放入3升X(g)和2升Y(g),在一定条件下发生下列反应:4X(g)+3Y(g)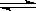 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是( )
2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是( )
A.3 B.4 C.5 D.6
22. 反应N2O4(g)
反应N2O4(g)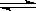 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com