
题目列表(包括答案和解析)
7.铜片和锌片用导线连接后插入稀硫酸中,锌片是
A.阴极 B.正极 C.阳极 D.负极
6.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,热化学方程式为
A. C + H2O == CO + H2 ΔH== +131.3KJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH== +10.94KJ·mol-1
C. C(s)+ H2O(l) == CO(g) + H2(g) ΔH== -131.3KJ·mol-1
D. C(s)+ H2O(g) == CO(g) + H2(g) ΔH== +131.3KJ·mol-1
5.已知299 K时,合成氨反应 N2 (g
) + 3H2 ( g )
 2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2
放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反
2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2
放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反
应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定
4. 下列关于反应热的说法正确的是( )
A.当∆H为“-”时,表示该反应为吸热反应
B.已知C(s)+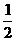 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
3.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
2.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
1.下列物质,属于强电解质的是A.NH3.H2O B.H2O C.CH3COONH4 D.CH3COOH
26.(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
|
测定时间/小时钟 |
0 |
1 |
2 |
4 |
|
pH |
4.73 |
4.62 |
4.56 |
4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为
▲ g/L
盐城中学2010届高中学业水平模拟测试试卷
25.(6分)A、B、C等八种物质有如下框图所示转化关系。又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。

请回答下列问题:
⑴ B的化学式是 ▲ ,F的化学式是 ▲ ,H的电子式为 ▲ ;
⑵ 写出A和B溶液反应的离子方程式: ▲ ;
⑶ 写出D和E反应的化学方程式: ▲ 。
⑷ 如何检验I中的阳离子 ▲
24.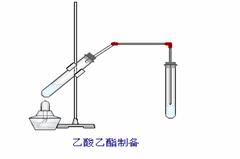 B.如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3-5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
B.如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3-5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
(1)写出左试管中主要反应的方程式: ▲ ; (2)在左试管中放入碎瓷片的作用是:
(3)加入浓硫酸的作用:___________________________▲____________________;
(4)饱和Na2CO3的作用是: _______________________▲______________________;
(5)反应开始时用酒精灯对左试管小火加热的原因是: ▲
_________▲________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)后改用大火加热的目的是 ▲ 。
(6)右试管中观察到的现象是:
(7)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ▲ ,所需主要仪器为 ▲ 。
(8)实验生成的乙酸乙酯,其密度比水 ▲ ,有 ▲ 气味。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com