
题目列表(包括答案和解析)
22.(8分)(1) (2)
(3) (4) ℃。
21.(6分) ; 。
26.(10分)在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:
(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的K
高二化学
25.某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从__________色变为_________色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视_________;
 (3)该小组在步骤①中的错误是____,由此造成的测定结果_____(填偏高、偏低或无影响);
(3)该小组在步骤①中的错误是____,由此造成的测定结果_____(填偏高、偏低或无影响);
(4)步骤②缺少的操作是__________;
(5)如图,是某次滴定时的滴定管中的液面,其读数为______mL;
(6)根据下列数据:
|
滴定次数 |
待测液体(mL) |
标准盐酸体积(mL) |
|
|
滴定前读(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度为_____▲______ mol/L
24.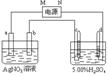 图中电极a、b分别为Ag电极和Pt电极,电极c、d 都是石墨电极。通电一段时间后,a质量减轻,在c、d有气体产生,两极上共收集到336mL(标准状态)气体。
图中电极a、b分别为Ag电极和Pt电极,电极c、d 都是石墨电极。通电一段时间后,a质量减轻,在c、d有气体产生,两极上共收集到336mL(标准状态)气体。
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 __g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质
的物质的量之比为:2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度 (填“增大”、“减小”或“不变”。下同),AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH _ __。
23.(1)氢氧燃料电池中,该电池通入H2一端作 极,电极方程式 ,通入O2一端作 极,电极的反应式是 (电解质溶液是KOH)
(2)电解质溶液如果换成稀H2SO4,正极的电极反应式 ,负极的电极反应式
22.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),判断此时的温度为 ℃。
21.有下列物质:①铜;②碳酸钙固体;③氢氧化钠固体;④氨水;⑤熔融硝酸钾;⑥乙醇;⑦液态氯化氢;⑧金刚石;⑨二氧化碳;⑩冰醋酸。其中能导电的有 , 属于非电解质的有 ;
20. 下列能用勒沙特列原理解释的是( )
①棕红色NO2加压后颜色先变深后变浅 ②.FeCl3溶液加热后颜色加深 ③.Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下 ⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 ⑥. SO2催化氧化成SO3的反应,往往加入过量的空气 A.①②⑤⑥ B.②③④ C.①③⑤ D.全部
第Ⅱ卷(非选择题,共60分)
18. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
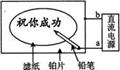 A.铅笔端有少量的氯气产生
B.a点是正极,b点是负极
A.铅笔端有少量的氯气产生
B.a点是正极,b点是负极
C.铂片端作阳极,发生氧化反应 D.铅笔端作阳极,发生还原反应
19在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是
A.Al3+、NH4+、SO42-、Cl- B.Na+、K+、CO32-、SO42-
C.K+、 Fe2+、Cl- 、NO3- D.Na+、Ba2+、Cl- 、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com