
题目列表(包括答案和解析)
27、在500gCuSO4溶液中插入两根电极,一极为铁,一级为粗铜(含锌)。通电一段时间后,立即将电极取出,这时铁极上析出7.04g铜。设粗铜全部反应,电解质溶液增重0.02g,求粗铜中含锌的质量分数。
26、如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内
容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 。
(2)由该实验可知,可以影响铁锈蚀速率的因素是 。
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法)
25、1918年,Lewis提出反应速率的碰撞理论。

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (“A”、“B”或“C”);
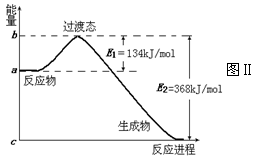
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
C-H |
Cl-Cl |
C-Cl |
H-Cl |
|
键能/ kJ·mol–1 |
X |
243 |
330 |
432 |
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X= 。
24、某同学用0.1×10×25mm、质量分数≥99.5%的铝片和酸反应制取H2,实验现象如下表:
|
时间 酸 |
1min |
2 min |
5 min |
15 min |
20 min |
|
3mol·L-1HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol·L-1H2SO4 |
均无明显现象(无气泡) |
(1)写出上述铝与酸反应的离子方程式 。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是 。
23.某化学反应2A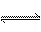 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
 实验 实验序号 |
 浓
度 时间 浓
度 时间温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为______________mol/(L· min)。
(2)在实验2,反应经20min就达到平衡,可推测实验2中还隐含的条件是_________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”“==”“<”),且c3_________1.0mol·L-1 (填“>”“=”“<”)。
22、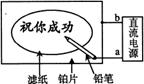 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。
(1)铅笔为 电源b为 (填写电极名称)
(2)产生此现象总反应的离子方程式
21、高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) ,已知1100℃时,K=0.263 。 1100℃时测得高炉中[CO2]=0.025mol/L
[CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是
Fe(s)+CO2(g) ,已知1100℃时,K=0.263 。 1100℃时测得高炉中[CO2]=0.025mol/L
[CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是
20、判断下列变化过程的焓变和熵变(用“>0”“=0”或“<0”填写)
|
变化过程 |
△H |
△S |
|
H2O(s)→H2O(l)→H2O(g) |
|
|
|
NaOH(s)=Na+(aq)+OH-(aq) |
|
|
N2(g)+3H2(g) 2NH3(g) 2NH3(g) |
|
|
19、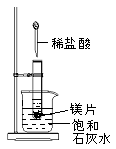 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中烧杯内的现象是__________________________
(2)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
18、将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com