
题目列表(包括答案和解析)
2.合成氨反应限度分析
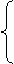 ①
①
有利于提高转化率的条件 ②
③
1.298K时,N2(g)+3H2(g)  2NH3 (g) ⊿H=-92.2KJ·mol-1 ⊿S=-198
J·K-1·mol-1
2NH3 (g) ⊿H=-92.2KJ·mol-1 ⊿S=-198
J·K-1·mol-1
(1)温度:从反应速率分析,温度 越好;从反应平衡分析,温度 越好。综合考虑以 K左右为宜,而且在此温度下 的活性最高。
(2)压强:无论从速率还是平衡考虑,压强 越利于合成氨。但压强越大,对设备的制造和材料的强度要求越高,应根据设备选择 的高压。
(3).催化剂: 反应速率但不影响平衡,提高单位时间氨的产量,目前工业上以
为催化剂
(4)浓度:从速率及平衡角度分析,应提高 , 浓度,降低 浓度。
24.一氧化碳发生反应CO(g)+H2O(g) 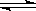 H2(g)+CO2(g),在773K时,平衡常数K==9,若反应开始时CO和H2O的浓度都是0.020 mol·L-1,试计算在此条件下,CO的转化率最大是多少?(4分)
H2(g)+CO2(g),在773K时,平衡常数K==9,若反应开始时CO和H2O的浓度都是0.020 mol·L-1,试计算在此条件下,CO的转化率最大是多少?(4分)
23.1 molCH4气体完全燃烧放出的热量为802 kJ,但不完全燃烧生成CO气体和液态水时,放出的热量为519 kJ,如果1 molCH4气体与n g O2燃烧生成CO、CO2气体和液态水,放出731.25kJ热量。
⑴写出CH4气体不完全燃烧的热化学方程式(2分) ⑵计算n的值(4分)
22.判断一个化学反应是否能够自发进行必须综合考虑反应的___ ____ _
(1)纯液体苯在其正常沸点等温汽化,则△H_______0,△S_______0
(填“>”, “<”,“==”,“不能确定”)
(2)已知反应:
A(s)=D(g)+E(g),(△H -T△S)=(- 4500 +11 T)J·mol-1,
要防止反应发生,温度(T)必须满足的条件为:____________
19.烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(锈斑为Fe(OH)3
失水的产物),这是常见的电化学化学腐蚀,试写出铁锅生锈的电极反应:
(1)负极
(2)正极
.
20.在2 L密闭容器中发生反应:3 X(g) + Y(g) 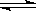 2Z(g) 若最初加入的X、Y、Z都是2 mol,X的平均反应速率为0.12 mol/(L·s),若要产物Z为2.6 mol,则反应需要的时间 秒。
2Z(g) 若最初加入的X、Y、Z都是2 mol,X的平均反应速率为0.12 mol/(L·s),若要产物Z为2.6 mol,则反应需要的时间 秒。
. 21.一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) +
O2 (g) 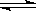 2 SO3 (g)
2 SO3 (g)
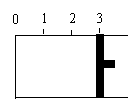 (1) 若活塞可自由移动,达平衡后,活塞由“3.0”
(1) 若活塞可自由移动,达平衡后,活塞由“3.0”
停止在“2.1”处,则该反应中SO2 的转化率为____
(2)一定温度下,使活塞固定在“3”处,
若开始时,充入容器的起始物质分别是:①2 L SO2 和1 L O2 ;
②2 L SO3 (g) 和 1 L N2 ; ③1 L SO2 、1 L O2 和 1 L SO3 (g),
则达到平衡后,容器中SO3 (g)的浓度大小关系是
(用序号和“<”、“=”、“>”表示)。
18.玻璃、陶瓷、水泥一定含 元素;水泥与 、
的混合物构成的混凝土常用钢筋做结构,这就是我
们常说的钢筋混凝土结构。
17.有“智力元素”之称的元素是 ;检验土豆中含有
淀粉的化学试剂是
16.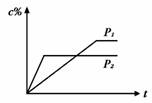 在温度相同,压强分别为P1和P2的条件下,A(g)+2 B(g)
在温度相同,压强分别为P1和P2的条件下,A(g)+2 B(g) 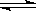 n
C(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是:
A.P1>P2,n<3 B.P1<P2,n<3 C.P1>P2,n>3 D.P1<P2,n>3
n
C(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是:
A.P1>P2,n<3 B.P1<P2,n<3 C.P1>P2,n>3 D.P1<P2,n>3
15.已知可逆反应N2O4(g) 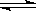 2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273K时,平衡常数K2=2.8×104,转化率为b%,则下列叙述正确的是:
2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273K时,平衡常数K2=2.8×104,转化率为b%,则下列叙述正确的是:
A.由于K2>K1 ,所以a>b B.由于K随温度升高而增大,所以此反应的△H>0
C.由于K随温度升高而增大,所以此反应的△H<0
D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com