
题目列表(包括答案和解析)
4.某化学研究性小组为模拟某自然现象,设计了如图
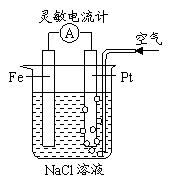 所示的装置。下列说法正确的是。
所示的装置。下列说法正确的是。
A.这是电解NaCl溶液的装置
B.Fe为阴极,其电极反应为:2Cl- → Cl2+2e-
C.这是一个原电池装置
D.Pt为正极,其电极反应为:2H++2e- → H2↑
3.古老的铁桥,经常每隔一段时间就要涂一遍油漆,但仍能看到有些地方有锈斑。下列有关说法中合理的是
A. 油漆只起美观作用,而与腐蚀无关
B. 铁桥生锈主要是铁与空气中的O2发生了化学腐蚀
C. 铁桥生锈主要是铁与空气中的O2、H2O等发生了电化学腐蚀
D. 铁桥腐蚀与外界环境无关,只由金属内部结构决定
2.化学平衡常数、速率常数、水的离子积常数、溶度积常数都与下列哪个量相关(即都随哪个物理量的变化而变化)
A.温度 B.浓度 C.压强 D.催化剂
1.四位同学在学习过化学反应速率和化学平衡理论以后联系化工生产实际发表的看法,你认为不正确的是
A.化学反应速率理论可指导怎样在一定时间内多出产品
B.化学平衡理论可指导怎样使用有限的原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产综合效益
14.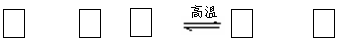 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K=;
(4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L.min),
则N2消耗速速率为v(N2)= mol/(L.min)。
13、合成氨反应,在一定条件下密闭容器中加入a mol N2,b mol H2,达到平衡时生成c mol NH3,则消耗N2的物质的量为______,消耗H2的物质的量为_______,N2的转化率为_______,若反应过程中保持恒定体积,恒定温度,则平衡容器内压强是原压强的______倍,容器中剩余N2的物质的量为______mol。
12、在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2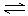 2NH3 △H<0
2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是______。
(2)保持体积不变,升高温度时,混合气体的平均式量_____,密度_____。
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将_______移动。
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将______移动。
(5)当达到平衡时,充入N2并保持压强不变,平衡将________移动。
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将____移动。
11.一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0% ,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7% B.20.0% C.80.0% D.83.3%
10、在一定温度下,一定体积的密闭容器中有如下平衡,H2(g)+I2(g) 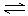 2HI(g),已知H2与I2的起始浓度均为0.1mol/L时,达到平衡时HI的浓度为0.16mol/L,若H2和I2的起始浓度均变为0.20mol/L,则平衡时H2的浓度(mol/L)是( )
2HI(g),已知H2与I2的起始浓度均为0.1mol/L时,达到平衡时HI的浓度为0.16mol/L,若H2和I2的起始浓度均变为0.20mol/L,则平衡时H2的浓度(mol/L)是( )
A.0.16 B.0.08 C.0.04 D.0.02
9、恒温恒压下,在容积可变的容器中反应2NO2(g)=N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时N2O4的体积分数( )
A 不变 B.增大 C.减小 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com