
题目列表(包括答案和解析)
14.常温下,0.1mol/L HX的pH=1,0.1mol/LCH3COOH pH约为2.9。下列说法正确的是
A.HX是一种弱酸
B.将0.1mol的HCl与0.1mol的HX溶于水配成1L混合溶液,所得溶液的c(H+)=0.11mol/L
C.等物质的量浓度等体积的HX与NaX两溶液混合,溶液中离子浓度大小关系为:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
D.在同体积的0.1 mol/LHX和0.1mol/LCH3COOH溶液中,分别加入0.1mol/L的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者
13.已知叠氮酸(HN3)的酸性与醋酸相似,其钠盐叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。下列叙述中错误的是
A.NaN3中存在的化学键有离子键和非极性共价键
B.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(H+)>c(OH¯)
C.N3¯与CO2含相等电子数
D.3molNaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊.
则A是Na3N
12.在一容器中加入a mol A和b mol B进行反应:mA(g)+nB(g) 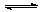 pC(g)+qD(g),下列判断正确的是
pC(g)+qD(g),下列判断正确的是
A.若温度不变,将容器的容积增大1倍,达到新平衡时,A的浓度变为原来的0.45倍, 则
B.若平衡时,A、B的转化率相等,说明反应开始时,a:b=m:n
C.若升高温度,平衡体系的平衡常数增大,说明该反应△H<0
D.若温度不变,将容器的容积压缩到原来的二分之一,达到新平衡时,压强大于原来的二倍
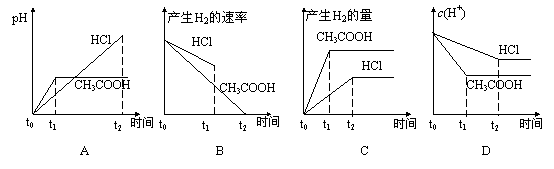
11. A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图所示,则下列判断正确的是
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图所示,则下列判断正确的是
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则A为强酸,B为弱酸
C.原酸溶液的浓度c(A)>c(B)
D.若2<a<5,则A、B都是弱酸,酸性A<B
10.在体积都为1L,pH ===2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是
9.已知Mg(s)+O2(g)= MgO(s) △H=Q1,2Hg(l)+O2(g)=2HgO(s) △H=Q2。现有反应Mg(s)+ HgO(s)= Hg(l)+ MgO(s) △H=Q3。则Q3应为
A.Q2-Q1 B.Q2 + Q1 C.Q1- Q2 D.2Q1 –Q2
8.下列性质中,不能说明乙酸是弱电解质的是
A.乙酸钠溶液显碱性
B.常温时,0.1 mol·L-1乙酸溶液的pH约为3
C.10mL 1mol·L-1乙酸溶液与10mL1mol·L-1的NaOH溶液恰好完全反应
D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸溶液的弱
7.有下列盐:① FeCl3 ② CH3COONa ③ NaCl,其水溶液的pH由大到小排列正确的是
A.①>③>② B. ②>③>① C.③>②>① D.①>②>③
6.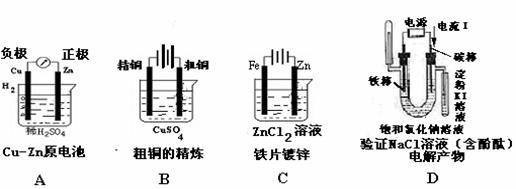 下图有关电化学的图示,完全正确的是
下图有关电化学的图示,完全正确的是
5.在闪电时空气中的N2和O2会发生反应:N2(g)+O2(g)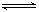 2NO2(g),已知该反应的△H =180.50 kJ·mol-1,△S = 247.7J·mol-1·K-1 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是
2NO2(g),已知该反应的△H =180.50 kJ·mol-1,△S = 247.7J·mol-1·K-1 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是
A.在1000℃时,此反应能自发进行
B.在1000℃时,此反应不能自发进行
C.该反应能自发进行的最低温度约为730℃
D.该反应能自发进行的最高温度约为730K
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com