
题目列表(包括答案和解析)
3.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法正确的是
( C )
A.CaO2的水解产物是Ca(OH)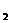 和H2O2 B.NaClO的水解产物之一是HClO
和H2O2 B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和平Mg(OH)2
2.下列对如图所示装置实验现象的描述正确的是 ( C )
|
|
a电极 |
B电极 |
x溶液 |
实验现象 |
|
A |
石墨 |
石墨 |
CuCl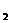 |
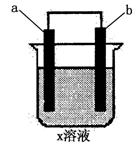 a极质量增加,b极放出无色气体 a极质量增加,b极放出无色气体 |
|
B |
Fe |
石墨 |
KNO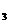 |
a极质量增加,b极放出无色气体 |
|
C |
Fe |
Cu |
CuSO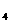 |
a极质量增加,b极质量减少 |
|
D |
石墨 |
石墨 |
HCl |
a、b极都放出无色气体 |
1.下列说法不正确的是 ( B )
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B. 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101KPa时 , 1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
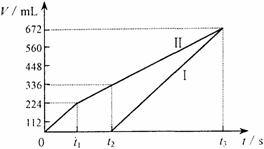 21.(8分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
21.(8分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
22. (10分)在1273k时在体积为1L的密闭容器中测得可逆反应:Fe(S)+H2O(g) FeO(s)
(10分)在1273k时在体积为1L的密闭容器中测得可逆反应:Fe(S)+H2O(g) FeO(s)
+H2(g)达到化学平衡状态时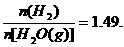
试解答下列问题:
(1)每生成1.00mol H2时,需通入水蒸气物质的量为多少?
(2)在1273k时,若向上述密闭容器中投入0.80mol还原铁粉,通入1.00 mol水蒸气,当达到化学平衡状态时,求密闭容器中各组分物质的量。
(3)在1273K时,上述密闭器中只有0.30mol还原铁粉,当通入1.00mol的水蒸气,求反应后密闭容器中存在那些组份,各组分物质的量是多少?此时密闭容器中状态是否达到化学平衡状态?
备选题:
20、(10分)能源是人类社会发展进步的物质基础,在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃ 101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式: 。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.200mol·L-1的K2Cr2O7溶液,再用0.3000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
 已知:CH3OH+Cr2O72-+8H+ CO2↑+2Cr3++6H2O
已知:CH3OH+Cr2O72-+8H+ CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式
②盛装(NH4)2Fe(SO4)2标准溶液的应为 (“酸式”或“碱式”)滴定管。
如果达滴定终点时,仰视读数,则读数偏 (“大”或“小”)
③此工业甲醇中CH3OH的质量分数___________________.
19.(10分)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液 表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
② 在上述(3)的体系中,能否实现AgY向AgX的转化?下面根据你的观点选答一项。
若不能,请简述理由:
若能,则实现转化的必要条件是:
18.(12分)有如下化学反应:2A(g)+B(g)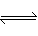 2C(g),△H<0。
2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有________________________
_________________________________________________。
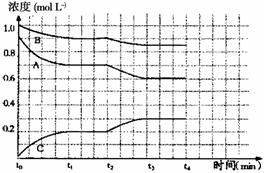
(4)如图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是________________ ,t2时曲线发生变化的原因是___________________________ ,若在t4时将B的浓度增大0.lmol·L-1,请在图中画出各物质浓度的变化情况。
17.(8分) I.(3分)有甲、乙、丙、丁四位同学分别设计了如下实验,证明盐类的水解是吸热的。其中正确的是___________________
甲:将硝酸铵溶于水,若水温下降,说明盐类水解是吸热的
乙:在盐酸中加入同浓度的氨水,若反应过程中温度上升,说明盐类水解是吸热的
丙:在醋酸中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
丁:在醋酸钠溶液中滴入酚酞试液,加热后红色加深,说明盐类水解是吸热的
II.(5分)已知25℃时,0.1mol·L-1的CH3COOH溶液pH约为3,向其中加入少量的CH3COONa晶体,晶体溶解后发现溶液的pH增大。对于上述现象有两种不同的解释:
甲观点:CH3COONa水解呈碱性,增大了c(OH-),因此溶液的pH增大。
乙观点:CH3COONa溶于水电离出大量的CH3COO-,抑制了CH3COOH的电离,使c(H+) 减小,因此溶液的pH增大。
请你设计一简单实验来验证上述观点哪个正确,试剂自选。(已知25℃时,0.1mol·L-1的NH3·H2O和0.1mol·L-1CH3COOH的电离常数均约为1.75×10‑5 )
16.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g),有图I
xC(g),有图I
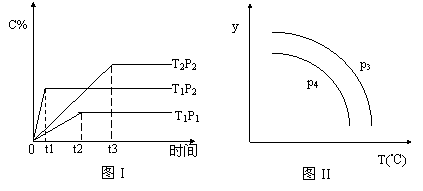
(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
A.P3>P4,y轴表示B的百分含量
B.P3<P4,y轴表示C的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
第Ⅱ卷(非选择题 共52分)
15.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
C.PH为11的溶液:S2-、SO32-、 S2O32-、Na+
D.所含溶质为NaCl的溶液:K+、SiO32-、NO3-、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com