
题目列表(包括答案和解析)
10.答案: (1) a ;b;
(2)0.08mol/L•min 增大NO2的浓度;
(3)BD
10. 已知NO2和N2O4可以相互转化:2NO2(g)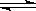 N2O4(g);△H < 0。
N2O4(g);△H < 0。
 现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题:
现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题:
(1)图中共有两条曲线X和Y,其中
曲线 表示N2O4浓度随时间的变化;
a、b、c、d四个点中,表示化学反应处
于平衡状态的点是 。
(2)25 min~30 min内用NO2表示的平均化学反应速率v(NO2)= mol/(L·min);反应进行至25 min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 。
A、升高温度 B、缩小容器体积 C、加入催化剂 D、加入一定量的N2O4
9. 答案:
答案: 




|

 吸氧 O2+2H2O+4e-=4OH- 两极与电源的正负极接反了,或铜棒接电源的负极了等。
或:
吸氧 O2+2H2O+4e-=4OH- 两极与电源的正负极接反了,或铜棒接电源的负极了等。
或:
|


 |
||||||
 |
||||||
 |
||||||
|
|
9.I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回
答:(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
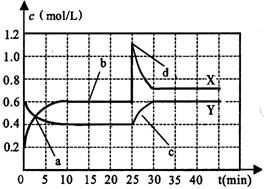
II.①某同学用碳棒、铜棒和稀硫酸为原材
料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
8. 答案(1)小于92.4 kJ (2)①C ②a+ c=1,b+
c=1,b+ c=4或2a+c=2,2b+3c=8
c=4或2a+c=2,2b+3c=8
③0.5<a≤1
8. .一定温度下,向装有固体催化剂且容积不变的密闭容器中通入1 molN2和4 molH2,使之发生如下反应:
.一定温度下,向装有固体催化剂且容积不变的密闭容器中通入1 molN2和4 molH2,使之发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH= -92.4 kJ·mol-1。
平衡时容器内气体压强为起始时的80%。
(1)通入1 mol N2和4 mol H2,达到平衡时,放出的热量为_________________________。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b molH2、c mol NH3。
达到相同的平衡时,①(1)与(2)放出的热量值___________(填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者 D.不能确定
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)_____________,
___________________。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是_____________________
7、在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
⑴甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是___ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质
⑵现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液
C.四氯化碳 D.硫氰酸钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
⑶根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
写出在溴化亚铁与氯气以物质的量之比为4:5反应时的离子方程式:
6. 如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C (Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是 (
C
)
如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C (Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是 (
C
)
A.C(Ⅰ)的电极名称是阴极
B.C(Ⅱ)的电极反应式是2Cl--2e-=Cl2↑
C. 电子从电源的负极沿导线流向C(Ⅱ)
D.电解过程中,C(Ⅰ)、C(Ⅱ)两极产生的气体质量相等
5.分析下图所示的四个原电池装置,其中结论正确的是 ( B )
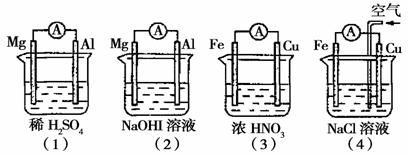
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-→6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe→Fe2++2e-
D.(4)中Cu作正极,电极反应式为:2H++2e-→H2↑
4.已知合成氨的反应为:N2(g)+3H2(g)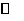 2NH3(g);△H=-QkJ·mol-1(Q>0)。在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是 ( A
)
2NH3(g);△H=-QkJ·mol-1(Q>0)。在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是 ( A
)
A.2Q2<Ql<Q B.2Q2=Q1<Q C.2Q2=Q1=Q D.Ql<Q2<Q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com