
题目列表(包括答案和解析)
7.一定量的盐酸与过量的锌粉反应时,为了减缓反应速率,但不影响生成H2的总量,可向盐酸中加入适量的 ( )
A、NaOH(固) B、H2O C、NaCl(固) D、CH3COONa(固)
5. 下列物质中,最难电离出氢离子的是( )
A.CH3COOH B. NaHCO3 C. H3PO4. D.H2SO4
6 下列事实一定能说明HNO2是弱电解质的是( )
①常温下 NaNO2溶液的 pH > 7;②用 HNO2溶液做导电实验灯泡较暗;③0.1mol/L 的 HNO2溶液的 pH 为 2.1;④用0.1mol/L的 HCl与0.1mol/L的HNO2与同浓度的NaOH 溶液恰好反应,消耗NaOH 溶液体积相同
A.①② B.①③ C.②③ D.③④
4. 在相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.电离度
C.H+的物质的量 D.CH3COOH的物质的量
3.下列说法正确的是( )
A.氯化钾溶液在电流作用下电离成钾离子和氯离子
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属弱电解质
D .纯净的强电解质在液态时,有的导电有的不导电
2.在RNH2·H2O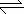 RNH
RNH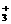 +OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
+OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体 C.加水 D.升温
1.甲酸的下列性质中可以证明它是弱电解质的是
A.1 mol·L-1的甲酸溶液的c(H+)约为0.01 mol·L-1
B.甲酸与水以任意比例互溶
C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1NaOH溶液完全反应
D.同温同压时,甲酸的导电性比一元强酸溶液的弱
3.以醋酸为例判断条件改变时,电离平衡的影响
|
|
平衡移动方向 |
c(H+) |
c(CH3COO-) |
c(CH3COOH) |
Ka |
|
升高温度 |
|
|
|
|
|
|
加水稀释 |
|
|
|
|
|
|
加纯醋酸 |
|
|
|
|
|
|
加NaOH |
|
|
|
|
|
|
加HCl |
|
|
|
|
|
|
加CH3COONa |
|
|
|
|
|
练习题
2、影响电离平衡的外界因素
(1)温度:温度升高,电离平衡 移动,电离程度 。
温度降低,电离平衡 移动,电离程度 。
(2)浓度:电解质溶液浓度越大,平衡 移动,电离程度 ;
电解质溶液浓度越小,平衡 移动,电离程度 ;
1、电离平衡常数:一元弱酸电离平衡常数:
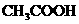


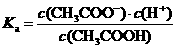
(1)电离平衡常数只随温度变化而变化,而与溶液浓度无关。
(2)K的意义:
K值越大,弱电解质较易电离,其对应弱酸、弱碱较 。
K值越小,弱电解质较难电离,其对应弱酸、弱碱较 。
19.(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______________。
(2)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为______________。
弱电解质的电离
重点回顾:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com