
题目列表(包括答案和解析)
7.物质的量浓度相同的下列溶液中,NH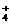 浓度最大的是 ( )
浓度最大的是 ( )
A.NH4NO3 B.NH4HSO4
C.CH3COONH4 D.NH4HCO3
6.将0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是 ( )
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)>c(CH3COO-)+c(Cl-)+c(OH-)
5.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是 ( )
A.H2Y的电离方程式为:H2Y+H2O H3O++HY-
H3O++HY-
B.在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.HY-的水解方程式为HY-+H2O H3O++Y2-
H3O++Y2-
D.在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+)
4.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中
c(Na+)>c(X-),则下列关系正确的是 ( )
A.c(OH-)<c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)=2c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-)
3.物质的量浓度相同(0.1 mol·L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是( )
A.c(Na+)+c(H+)=c(X-)+c(OH-)
B.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.c(HX)+c(X-)=2c(Na+)
D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
2.在常温下10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V后≥20 mL D.V后≤20 mL
1.常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
(五)盐类水解原理的应用
1.制备胶体或解释某些盐有净水作用
FeCl3、Kal2(SO4)2·12H2O等可作净水剂.
原因: .
2.某些盐溶液的配制、保存
在配制FeCl3、AlCl3、SnCl2等溶液时为防止水解,应加入少量 .Na2SiO3、Na2CO3等不能贮存磨口玻璃塞的试剂瓶中,因
3.泡沫灭火器内反应原理.
NaHCO3和Al2(SO4)3混合可发生双水解反应:
4.热的纯碱液去油污效果好.原因:
5.铵态氮肥不能与草木灰混合使用:
盐类水解练习题
(四)比较外因盐水解的影响.
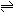 A-+H2O
HA+OH-
A-+H2O
HA+OH-
温度(T)T↑ 平衡 移, 水解程度
加水 平衡 移, 水解程度 。 增大[H+] 平衡 移, 水解程度
增大[OH-] 平衡 移, 水解程度 。 增大[A-] 平衡 移, 水解程度
思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?
②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度 和CH3COO-水解程度各有何影响?
(三)影响水解的因素 内因:盐的本性.
外因:浓度、温度、溶液碱性的变化
(1)温度不变,浓度越小,水解程度 .
(2)浓度不变,温度越高,水解程度 .
(3)改变溶液的pH值,可抑制或促进水解。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com