
题目列表(包括答案和解析)
1.下列有关物质的表达方式不正确的是
A. CH4分子的比例模型:
B.溴乙烷的电子式: 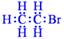
C.甲醛的结构式: 
D.葡萄糖的结构简式:CH2OH(CHOH)4CHO
22.(8分)
I.体积为5 L的恒温恒容密闭容器甲起始投入
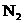 ,
,
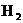 ,经过
,经过 达到平衡,测得平衡时
达到平衡,测得平衡时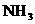 的物质的量为
的物质的量为 ;
;
Ⅱ.容器乙起始投入
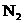 ,
,
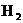 ,维持恒温恒压到平衡,测得平衡时
,维持恒温恒压到平衡,测得平衡时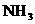 的物质的量为
的物质的量为 ;
;
已知甲乙达到平衡时,温度、压强以及相同组分的体积分数均相同。
(1)容器甲 内用
内用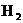 表示的平均反应速率
表示的平均反应速率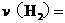
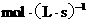 。
。
(2)下列哪些情况表明容器乙已达到平衡状态 。
A.容器乙的气体密度不再变化
B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率
D.断裂 氮氮三键同时断裂
氮氮三键同时断裂 氮氢键
氮氢键
(3)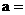


四川省南充市08-09学年高二教学质量监测
21.(14分)
将加热至红热的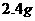 2木炭投入盛有足量
2木炭投入盛有足量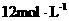 的浓
的浓 的试管中,立即塞好塞子,如下图所示,连接好(事先已检查装置的气密性)。请回答:
的试管中,立即塞好塞子,如下图所示,连接好(事先已检查装置的气密性)。请回答:

(1)反应开始后撤去酒精灯,试管a中除看到木炭剧烈燃烧,最后消失外,还观察到的现象是 。
(2)试管中b最终 沉淀产生(填“有”“无”),原因是 。
(3)试管c中发生反应的化学方程式为 。
(4)集气瓶e中最后收集到的气体为 ,理论上该气体的总体积为 L
(标准状况时保留2位有效数字),实际上比这个数值 (填“大”或“小”)。
20.(9分)
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:

(1)写出下列物质的化学式:A ;F ;J ;
(2)写出由B生成F和K的离子反应方程式 。
(3)溶液I中所含金属离子是 。
(4)由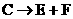 若改用浓酸,则不能选用的浓酸是(写化学式) 、
。(写两种)
若改用浓酸,则不能选用的浓酸是(写化学式) 、
。(写两种)
19.(8分)
烧过菜的铁锅未及时洗去含有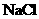 的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为
的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为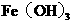 失水的产物。
失水的产物。
(1)请你表示此时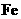 被腐蚀的电极反应式:
被腐蚀的电极反应式:
负极 ,正极
(2) 和
和 溶液反应生成
溶液反应生成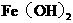 的离子方程式:
的离子方程式:
(3) 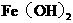 与
与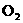 和水反应转化为
和水反应转化为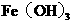 的化学方程式:
的化学方程式:
18.(10分)现有下列溶液
①

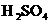 溶液;②
溶液;②

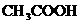 溶液;③
溶液;③

 溶液;④
溶液;④

 溶液;⑤
溶液;⑤

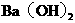 溶液,其中:
溶液,其中:
(1)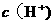 最大的是
;
最大的是
;
(2)混合后出现白色沉淀的两种溶液是 ;
(3)任取2份溶液混合,混合后溶液的 为7,有
种取法;
为7,有
种取法;
(4)②和④混合后,溶液的 ;(选填“>7”,“<7”或“=7”)
;(选填“>7”,“<7”或“=7”)
(5) 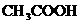 溶液和
溶液和 溶液反应,若反应后溶液的
溶液反应,若反应后溶液的 为7,则
。
为7,则
。
A.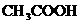 与
与 的质量相等
的质量相等
B.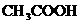 与
与 的物质的量相等
的物质的量相等
C. 过量
过量
D.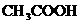 过量
过量
17.
 的
的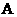 、
、 两种酸溶液各
两种酸溶液各 ,分别加
,分别加
水稀释到 ,其溶液的
,其溶液的 与溶液体积(
与溶液体积(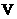 )
)
的关系如右图所示,则下列说法不正确的是( )
A.稀释后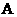 酸溶液的酸性比
酸溶液的酸性比 酸溶液弱
酸溶液弱
B.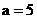 时,
时,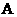 是强酸,
是强酸, 是弱酸
是弱酸
C.若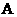 、
、 都是弱酸,则
都是弱酸,则
D.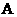 、
、 两种酸溶液物质的量浓度一定相等
两种酸溶液物质的量浓度一定相等
第Ⅰ卷答题栏
试卷登分栏
|
第Ⅰ卷 |
第Ⅱ卷 |
总分 |
总分人 |
||||
|
一 |
18 |
19 |
20 |
21 |
22 |
||
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共49分)
16.某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是( )
A. 、
、 B.
B. 、
、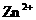
C.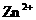 、
、 D.
D.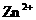 、
、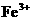
15.将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
|
金属 |
电子流动方向 |
电压/V |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
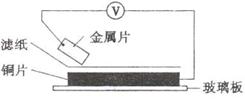
请依据记录数据判断,下列有关说法正确的是( )
A. 在四种金属中C的还原性最强
B. 金属B能从硫酸铜溶液中置换出铜
C. A、D若形成原电池时,A为正极
D. A、B形成合金时,将该合金露置在空气中,B先被腐蚀
14.设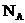 表示阿伏加德罗常数,下列叙述中正确的是( )
表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,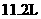 氧气所含的原子数为
氧气所含的原子数为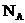
B.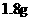 的
的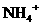 离子中含有的电子数为
离子中含有的电子数为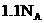
C.常温常压下,
 含有的氧原子数为
含有的氧原子数为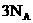
D. 金属镁变为镁离子时失去的电子数为
金属镁变为镁离子时失去的电子数为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com