
题目列表(包括答案和解析)
2. 生物质能是绿色植物通过叶绿体将太阳能转化为化学能而贮存在生物质内部的能量,它一直是人类赖以生存的重要能源。下列有关说法不正确的是
A.生物质能是可再生性能源
B.沼气是由生物质能转换而来化石能源,其主要成分是碳氢化合物
C.乙醇汽油是混合型能源,乙醇可由富含淀粉的谷物发酵产生
D.用油料作物生产的“生物柴油”成分与从石油中提取的柴油成分相同
1. 山西古交市屯兰煤矿2009年2月22日发生瓦斯爆炸事故,造成77人遇难。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
A.甲烷分子是一种呈正四面体型的、含极性键的分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
22.在500rnL 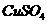 和
和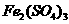 的混合液中加入21.7g铁粉,待完全反应后,得到16.8g残留固体,在滤液中加入400mL 4mol/L的
的混合液中加入21.7g铁粉,待完全反应后,得到16.8g残留固体,在滤液中加入400mL 4mol/L的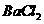 溶液,恰好使溶液中的
溶液,恰好使溶液中的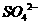 完全沉淀。
完全沉淀。
请回答:
(1)写出属于氧化-还原反应的有关离子方程式: 。
(2)计算确定16.8g残留固体的成分。
(3)计算原混合溶液中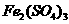 的物质的量浓度。
的物质的量浓度。
桂林市2008~2009学年度上学期期末质量检测
21.某学生设计了以下实验方案,验证铜和一定量(10mL)浓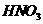 反应过程中会产生
反应过程中会产生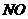 气体,实验装置如下图所示(装置的气密性良好),请回答下列问题:
气体,实验装置如下图所示(装置的气密性良好),请回答下列问题:
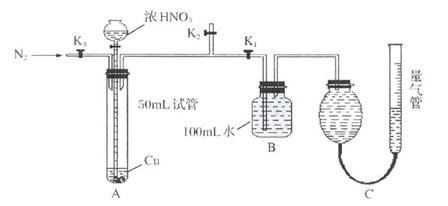
(1)在反应前通入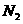 的作用是
,进行这步操作时应打开
的作用是
,进行这步操作时应打开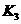 和 (填
和 (填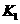 、
、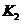 。下同),而关闭
。
。下同),而关闭
。
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,此步骤的目的是 。
(3)B中发生的反应化学方程式 。用C装置读排出水的体积时,应注意 。
(4)若实验结束后,测得B容器中所得溶液体积是l00mL,溶质物质的量浓度是0.08mol/L,C装置中气体的体积为120.0mL(已折算成标准状况),那么上述反应过程是否有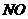 生成
(填“有”或“无”),判断的依据是
。
生成
(填“有”或“无”),判断的依据是
。
20.下图是几种物质的转化关系:
A、B、C、D、E均为中学化学常见的物质,它们间的反应关系如下图所示。
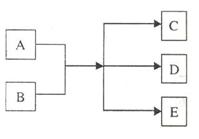 (1)若A是金属,B是浓溶液,反应后生成蓝色溶液和红棕色气体。写出该反应的离子方程式
。
(1)若A是金属,B是浓溶液,反应后生成蓝色溶液和红棕色气体。写出该反应的离子方程式
。
(2)若A、B都是固体,加热后,生成的气体C能使湿润的红色石蕊试纸变蓝。要收集到干燥的气体C,选用的干燥剂是 。写出实验室制取气体C的反应方程式 。
(3)若A是可溶性强碱,B是正盐,生成的气体C靠近浓盐酸产生大量白烟,D不溶于稀硝酸。写出A和B反应的化学方程式 。
19.(11分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定 的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用。
(2)将标准盐酸装在25.00mL的 滴定管中,调节液面位置在“0”刻度以下,并记录下刻度。
(3)取20.00mL待测液。该项实验操作使用的主要仪器有 。用酚酞作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算 的质量分数为
。
的质量分数为
。
(5)试分析滴定误差可能由下列哪些实验操作引起 (选填编号)。
A.(1)中,转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读滴定管开始时仰视,读终点时俯视
18.(10分)在一定条件下,可逆反应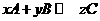 达到平衡。若:
达到平衡。若:
①升高温度,可使C的质量分数增大,则正反应是 反应(放热或吸热)。
 ②A、B、C都是气体,减小压强,平衡向正反应方向移动,则
②A、B、C都是气体,减小压强,平衡向正反应方向移动,则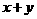
 (大于或等于或小于)。
(大于或等于或小于)。
③满足上述①、②题中的条件,能使A、B转化率都增大的措施有 、 (填两项措施即可)。
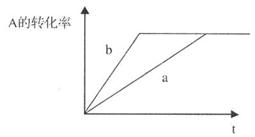
④A、C都是气体,B为液体,且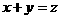 ,右图中曲线a代表一定条件下的反应过程,如果使a曲线变为b曲线,可以采用的措施是
。
,右图中曲线a代表一定条件下的反应过程,如果使a曲线变为b曲线,可以采用的措施是
。
17.(5分)请将5种物质: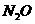 、
、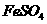 、
、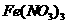 、
、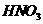 和
和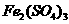 ,分别填入下面对应的横线上,组成一个未配平的化学方程式。
,分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) + → + + +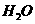
(2)组成的化学方程式配平后,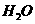 前面的系数为
。
前面的系数为
。
16.(4分)将pH=11的氨水和pH=3的盐酸等体积混合,所得溶液呈 (填“酸”或“中”或“碱”)性,该溶液中所有离子浓度由大到小的顺序为 。
15.将足量的铜屑加入到浓度均为2mol/L的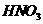 和
和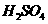 的混合溶液1L中,充分反应后,转移电子的物质的量为(提示:硫酸提供
的混合溶液1L中,充分反应后,转移电子的物质的量为(提示:硫酸提供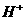 使反应继续进行)
使反应继续进行)
A.4.5mol B.5.5mol C.6.5mol D.8mol
第Ⅱ卷非选择题(共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com