
题目列表(包括答案和解析)
19.(共6分)(1)A(2分) (2)2H++ 2e-= H2↑ (2分)
(3)2Fe3++ Fe = 3Fe2+ (2分)
18.(共8分)(1)⑤⑥(2分) ①④(2分)
(2)2Fe3++3CaCO3+3H2O = 2Fe(OH)3+3Ca2++3CO2↑ (2分)
或;2Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
(3)HCO3-+A1O2-+H2O=Al(OH)3↓+CO32-(2分)
17.(共8分)(1)Fe2O3+2A1 2Fe+Al2O3(2分) 放热(1分) KC1O3(1分)
2Fe+Al2O3(2分) 放热(1分) KC1O3(1分)
受热分解产生O2,助燃(2分)
(2)③ ④(各1分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
B |
A |
D |
C |
A |
D |
C |
A |
B |
D |
C |
B |
D |
C |
B |
A |
第II卷非选择题(共52分)
22.(8分)现有Al和Na的混合物28.4g,投入足量水中,充分反应后,无固体剩余,在标准状况下共收集到气体17.92L;然后向其中加入2mol/L的稀盐酸,若最终溶液仍然保持澄清。
求:(1)Al和Na的质量分别是多少?
(2)加入稀盐酸体积V的取值范围
高二年级化学期末考试试题
第I卷(选择题共48分)
21.(13分)某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,并测定该废铁纸屑中铁的纯度,设计了下面实验装置图。A中放有m g废铁屑,烧杯中盛有过量的过氧化氢溶液。回答下列问题:
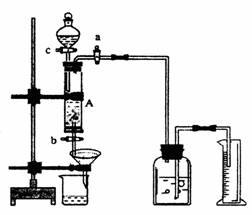
(1)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,装置A中可观察到的现象是 ;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是
(2)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中, 发生反应的化学方程式为:
(3)要从烧杯内溶液得到FeCl3·6H2O,晶体,主要操作包括: ,
不能将烧杯内溶液直接加热蒸干来制备FeCl3·6H2O晶体,理由是: 。
(4)实验室若没有过氧化氢,可用下列 试剂代替(填选项);
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(5)若要测废铁屑中铁的纯度,测出放出气体的体积VL(己折算成标准状况),则废铁屑的纯度为: (用m、V的代数式表示)。
20.(9分)物质A-I 以及X有如下转化关系。已知:只有A、B、D为单质,有些反应的条件和部分产物省略未写。
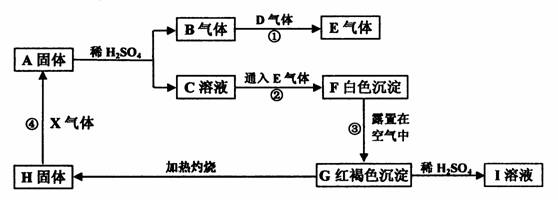
(1)写出下列物质的化学式∶A D 。
(2)写出框图中对应化学方程式:
③
④ 。
(3)书写图中反应②的离子方程式: 。
(4)在I溶液中加入足量固体 (填物质的化学式)可转化得到C溶液,且溶液中不含其它杂质。
19.(6分)将Fe片和石墨用导线相连,一组插入稀H2SO4中,一组插入FeCl3溶液中,分别形成了原电池。
(1)这两个原电池中,正极分别是 。
A.石墨、石墨 B.石墨、Fe片 C.Fe片、Fe片 D.Fe片、石墨
(2)写出插入稀H2SO4中形成原电池的正极反应式(用离子方程式表示) 。
(3)写出插入FeCl3溶液中形成原电池的电池反应式(用离子方程式表示) 。
18.(8分)(1)下列微粒中:
①Na+;②NH4+;③ClO-;④C1-;⑤HCO3-;⑥HS-; ⑦CO32-;⑧HSO4-
A.既能电离,又能水解的微粒是 。
B.既不能电离,又不能水解的微粒是 。
(2)向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,同时有红褐色沉淀生成,其离子方程式为 。
(3)0.1 mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11,将两种溶液等体积混合,己知发生反应的现象是有白色沉淀生成,该反应的离子方程式为: 。
17.(8分)现行教材中给我们介绍的“铝热反应”是用铝粉和氧化铁混合物,在镁条燃烧产生的高温下发生反应的。
(1)该反应的化学方程式为: ;
该反应是 (填“吸热”或“放热”)反应;以上叙述中除镁条外,还缺少一种药品,它是 ,在该反应中的作用是 。
(2)工业冶金常用以下四法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。
用“铝热反应”原理冶炼金属锰属于 ;从海水中提取单质镁属于 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com