
题目列表(包括答案和解析)
17、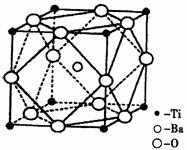 人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为钛(22Ti),它被誉为“未来世纪的金属”。
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
(1)22Ti元素基态原子的价电子层排布为 ;
(2)在Ti的化合物中,可以呈现+2、+3、
+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的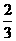 。
。
则绿色晶体配合物的化学式为 ,绿色晶体中含有化学键类型是 。
16、C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A 强 B 弱 C 相等 D 无法判断
15、(15分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
H |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
G |
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
J |
|
(1)表中用字母标出的元素中,化学性质最不活泼的是 (用元素符号表示,
下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示),在周期表中铁的位置: 。
(2)D、F、B气态氢化物中以 最不稳定(填化学式)。B的气态氢化物中B元素采取 方式杂化,其空间构型为 。
(3)第三周期中原子半径最小的是 。与BD2互为等电子体的物质有 。
(4)B和E的最高价氧化物对应的水化物中酸性较强的是 。(填化学式)
写出可以验证该结论的一个离子反应方程式 。
(5)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(6)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式 。
14.下列数据是对应物质的熔点,有关的判断错误的是( )
|
Na2O |
Na |
AlF3 |
AlCl3 |
Al2O3 |
BCl3 |
CO2 |
SiO2 |
|
920℃ |
97.8℃ |
1291℃ |
190℃ |
2073℃ |
-107℃ |
-57℃ |
1723℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
13、通过复习总结,你认为下列对化学知识概括合理的是( )
A.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.发生化学反应时失去电子越多的金属原子,其单质的还原性越强
C.核外电子总数相同的原子,一定是同种元素的原子
D.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
12、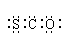 最新研究表明生命可能起源于火山爆发,因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
最新研究表明生命可能起源于火山爆发,因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
A.羰基硫属于非极性分子 B.羰基硫的电子式为
C.羰基硫的沸点比CO2低 D.羰基硫分子中三个原子处于同一直线上
11、X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A.X:3s23p1 Y:3s23p5 B.X:2s22p3 Y:2s22p4
C.X:3s23p1 Y:2s22p5 D.X:2s22p3 Y:1s1
10、下列事实能够用键能大小解释的是( )
A.单晶硅沸点比金刚石低 B.通常情况下,氮气的化学性质非常稳定
C.常温常压下甲烷与戊烷的状态不同 D.稀有气体一般难以发生化学反应
9、 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2
D.若Y的最高正价为+ m,则X的最高正价一定为+ m
8、下列叙述中错误的是( )
A.能跟酸反应的氧化物,不一定是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109°28′
C.有新单质生成的化学反应不一定都是氧化-还原反应
D.原子晶体中一定含有共价键,离子晶体一定含有离子键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com