
题目列表(包括答案和解析)
6.下列有关叙述正确的是
A.将AlCl3溶液加蒸干制得无水AlCl3
B.输油管道为了防止表面被腐蚀应涂上隔水材料并与电源的正极相连
C.pH=9的NaOH溶液和Na2CO3溶液,两溶液中OH―离子浓度不同
D. 配制FeCl2溶液时,可将FeCl2固体溶于盐酸,再加水稀释和少量的铁屑保存
5.在H2S的饱和溶液中存在下列平衡①H2S 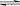 H++HS- ②HS-
H++HS- ②HS- 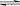 H++S2-,下列哪种措施,既可增大c(S2-),又能提高pH,又可减小H2S的电离程度的是
H++S2-,下列哪种措施,既可增大c(S2-),又能提高pH,又可减小H2S的电离程度的是
A.加NaOH B.通入H2S气体 C.降温 D.加入Na2S晶体
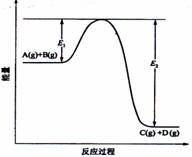
4.反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,下列叙述中正确的是
C(g)
+D(g)过程中的能量变化如图所示,下列叙述中正确的是
A.该反应是吸热反应
B.当反应达到平衡时,升高温度,A的转化率增大
C.反应体系中加入催化剂对反应热没有影响
D.在反应体系中加催化剂,反应速率增大,E1减小E2增大
3.下列措施或事实能用勒沙特列原理解释的是
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI三者的平衡混合气加压后颜色变深
 C.钢铁在潮湿的空气中更容易生锈
C.钢铁在潮湿的空气中更容易生锈
D.含有酚酞的氨水中加入少量的氯化铵溶液的颜色变浅
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.酸碱中和时的反应热:H+(aq)+OH-(aq)=H2O(l); △H= + 57.3 kJ·mol-1
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.明矾水解的离子方程式: Al3++3 H2O===Al(OH)3 ↓+3H+
 D.醋酸溶于水的电离方程式:CH3COOH+H2O CH3COO-+H3O+
D.醋酸溶于水的电离方程式:CH3COOH+H2O CH3COO-+H3O+
1.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5摩/升盐酸 C.0.5摩/升醋酸 D.0.5摩/升氯化铵溶液
21、(12分)
分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为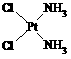 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为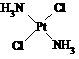 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是 ;Ni元素与Pt元素位于同一族,写出Ni元素原子结构示意图: 。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: 。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
20、(11分)已知A、B、C均为短周期元素形成的单质,且元素A、B同周期,A元素原子半径大于B元素原子半径,在一定条件下单质A和单质B、单质A和C都按物质的量2∶1反应,分别生成X和Y,在产物中B、C两元素呈负价。
分别取3份完全相同且质量均为1.52g由单质A和单质B组成的混和物进行下列实验:
①在第一份样品中加入过量盐酸,充分搅拌后在标准状况下放出0.896L H2残留不溶于酸的固体0.56g
②在第二份样品中加入过量浓NaOH溶液,微热充分反应后在标准状况下放出0.896L H2残留不溶于碱的固体0.96g
③将第三份样品隔绝空气加强热生成化合物X,将X投入稀盐酸中,X溶解且放出在空气中能自燃的气体a L
根据上述题给信息和实验记录解答下列问题
(1)写出下列元素的名称: A: ;B: ;C: ;
(2)混和物中B的质量分数是:
(3)写出实验③中有关反应的化学方程式
, a的值为 。
19、(10分)Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
______________________________________________________。
Ⅱ.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:_______________________________
__________________________________________________________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 __ ____ ,基态Cu原子的价电子排布式为___________________________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
18、(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com