
题目列表(包括答案和解析)
16.(12分) 现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2固体,首先将其制成水溶液,然后按下图所示步骤进行提纯:
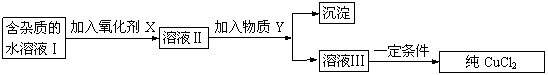
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是__________________________________________。
(3) 物质Y不可以是 ___________;
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
加入Y可以达到实验目的的理由是 .
(4)最后能不能直接蒸发结晶得到CuCl2? ______(填“能”或“不能”)。
如不能,应如何操作?(如能,此空不填)_________________________________________。
15.(4分)下列实验操作或对实验事实的叙述正确的是___________(填序号)。
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
⑤中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
⑥滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
14.下列溶液中,各微粒的物质的量浓度关系正确的是
A.0.1 mol / L的(NH4)2SO4溶液中:c(SO42-)>c( NH4+)>c(H+)>c(OH-)
B.0.2 mol / L Na2CO3溶液中:c(OH-)=c(HCO3-) + c(H+) +2c(H2CO3)
C.0.1 mol / L NH4Cl溶液与0.05 mol / L NaOH溶液等体积混合后,溶液呈碱性:
c(Cl-)>c(Na+)>c( NH4+)>c(OH-)>c(H+)
D.NH4+浓度相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液的浓度大小关系:
c [(NH4)2SO4] >c [(NH4)2CO3] >c [NH4Cl]
第II卷(非选择题,共72分)
13.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
12.现有常温下的四种溶液(如下表),下列有关说法不正确的是
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
硫酸 |
|
pH |
11 |
11 |
3 |
3 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH大小关系是:②>①>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中c(NH4+)<c(SO42-)
D.V1 L④与V2 L②溶液混合后,若混合后溶液pH=4,则V1∶V2= 11∶9
11.一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.以X的反应速率为0.001 mol·L-1·s-1
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
10.在25℃时,水的电离达到平衡:H2O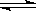 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
D.将水加热,Kw增大,溶液仍为中性,pH不变
9.下列各环境下的离子组合一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.某溶液中: Al3+、NH4+、SO42―、HCO3 ―
C.c(H+)=10-14 mol/L的溶液中:Na+、AlO2-、S2-、SO32-
D.由水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、CO32-、Cl-、K+、
8.阿伏加德罗常数为NA ,下列叙述中,正确的是
A.同温时,1L 0.5 mol / L NH4Cl溶液与2L 0.25 mol / L NH4Cl溶液所含NH4+物质的量不同
B.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.2NA
C.0.1L 2 mol / L的碳酸钠溶液所含CO32-离子的总数为0.2NA
D.1L 0.5 mol / L的蔗糖溶液中含有的分子总数为0.5NA
7.用0.1mol/L盐酸分别与25mlNaOH溶液和25ml氨水完全反应,都消耗了25ml盐酸,这表明NaOH溶液和氨水的关系是
A.PH相同 B.物质的量浓度相同
C.电离平衡常数相同 D.反应后所得溶液的PH相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com