
题目列表(包括答案和解析)
6. (07年高考广东理基·24)下列关于元素周期表和元素周期律的说法错误的是C
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
5. (07年高考理综天津卷·7)2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是A
A.钅仑 第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
4. (08年广东化学·1)2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于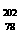 Pt的说法正确的是A
Pt的说法正确的是A
A.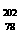 Pt和
Pt和 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.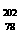 Pt和
Pt和 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.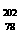 Pt和
Pt和 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. Pt和
Pt和 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
3. (08年广东理基·27)根据表1信息,判断以下叙述正确的是C
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
2. (08年广东理基·26)下列有关原子结构和元素周期律表述正确的是C
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③
C.②④ D.③④
Ⅰ卷选择题
1. (08年四川理综·9)下列叙述中正确的是C
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的租序数
B.除点周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
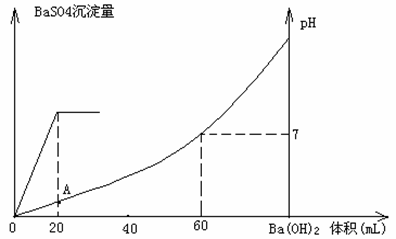
20(12分).硫酸和盐酸混合溶液20mL,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4
沉淀量及溶液pH发生如下图所示的变化。
⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵在A点溶液的pH是多少
19.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a 7(填>、<或=),则HA为强酸;
若a 7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度(A-)与(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
。
(4)丁组实验所得混合溶液中由水电离出的c(H+)= mol·L-1。
18.(15分)(1)在某温度下,H2O的离子积常数为1×10-13,则在该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH=
(2)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
(3)相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
17.(15分)若用浓度为0.2mol·L-1的标准盐酸滴定一未知浓度的氢氧化钠溶液(一、二两次滴定),再用此氢氧化钠溶液滴定另一未知浓度的盐酸(三、四两次滴定),滴定时纪录了以下4组数据:
|
滴定次数 |
待测碱(酸)溶液体积V/mL |
标准酸(碱)溶液 |
||
|
滴定前刻度 |
滴定后刻度 |
消耗体积/mL |
||
|
第一次 |
10.0(NaOH) |
0 |
10.42 |
|
|
第二次 |
10.0(NaOH) |
12.20 |
22.78 |
|
|
第三次 |
10.0(HCl) |
0 |
11.42 |
|
|
第四次 |
10.0(HCl) |
11.10 |
22.54 |
|
(1)由以上数据可算出待测碱液浓度为 mol·L-1,待测酸液浓度为 mol·L-((2)在三、四两次滴定中,应选用 作指示剂,达滴定终点的现象是
.
(3)若在滴定实验过程中存在下列操作,其中会使待测液的浓度偏小的是 .
A.锥形瓶水洗之后未用待测液润洗
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.装标准液的滴定管未用标准液润洗
D.滴定前仰视读数,滴定后俯视读数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com