
题目列表(包括答案和解析)
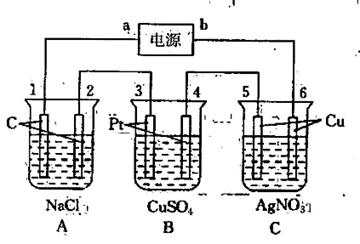
22.(重)(6分)如下图所示,通电5min后,电极5的质量增加2.16g,回答:
(1)电源a是 极,A池阴极电极反应:
(2)如果B槽中共收集到224mL气体(标准状况)且溶液体积为200mL(设电解过程中溶
液体积不变),则通电前溶液中Cu2+的物质的量浓度为
(3)如果A池溶液也是200mL(电解过程溶液体积不变)-则通电后,溶液的pH为
.
22.(普)(6分)电解是在电流的作用下,分别在两极
发生 的过程。若电解足量的氯化铜溶液一段时间后,电路中转移0.2mol的电子,则阴极析出金属铜 克,阳极在标准状况下放出氯气 升。
21.(重)(6分)pH=2的A、B两种酸溶液各lmL
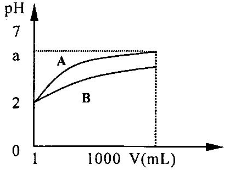 分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)
分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)
的关系如右图所示,回答问题
(I) 起始时两种酸溶液物质的量浓度的关系A
B;(填>、=、<)
(2)稀释到1000ml后两溶液的酸性强弱为A
B;(填>、=、<)
(3)若a=5,则A是 酸,B是 酸;
(4)若A、B都是弱酸,则a的范围 。
21.(普)(6分)化学平衡状态是指在一定条件下的可逆反应中, 的状态。
化学平衡常数值越大,说明该反应转化率 。使用催化剂对化学平衡
20.(重)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧
化碳。该电池负极发生的反应是
A.CH30H(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e_
B.O 2(g)+4H+(aq)+4e_=2H20(1)
C.O2(g)+2H2O(1)+4e_=40H_
D.CH30H(g)+H2O-6e_(1)=CO2(g)+6H+(aq)
第Ⅱ卷(非选择题50分)
20.(普)在一密闭容器中,可逆反应:aA(g)+bB(g) cC(g)达平衡后,测得此时C的
cC(g)达平衡后,测得此时C的
浓度为0.6 molL-1若保持温度不变,将容器的容积压缩为原来的一半,当重新达
平衡后,C的浓度是0.8mol·L-1下列说法正确的是
A.物质A的转化率增大了 B.平衡向正反应方向移动
C.物质c的质量分数增加了 D.a+b<c
19.(重)一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总
量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa
固体 ⑤NaNO3溶液 ⑥KCl溶液
A.②④⑤⑥ B.①② C.②③⑤ D.②④⑥
19.(普)实验中要快速制取氢气,最好的方法是
A.纯锌和稀硫酸反应 B.纯锌和浓硫酸反应
C.粗锌和浓硫酸反应 D.粗锌(含铅铜杂质)与稀硫酸反应
18.(重)反应4NH3(g)+S02(g) =====4NO(g)+6H2O(g)在2 L的密闭容器中进行,分钟后
NH,减少了0.12 mol,则平均每秒钟各物质浓度变化正确的是
A.H20:0.002 mol.L-1 B.NO:0.001mol.L
C.NH3:0.002 mol·L-1 D.O2:0.001 mol·L-1
18.(普)在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过
2SO3(气),已知反应过
程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,
当反应达平衡时,可能存在的数据是
A.SO2为0.4mol/L、02为0.2moI/L B.S02为0.25mol/L
C.S02、SO3均为0.15mol/L D.S03为0.4mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com