
题目列表(包括答案和解析)
3.(8分)某课外活动小组用实验确定某酸HA是弱电解质。甲乙两同学的方案是:
甲方案:① 称取一定质量的HA配制0.l mol·L-1的溶液100 mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙方案:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100 mL;
② 分别取这两种溶液各10mL,加水稀释为100 mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
。
2.(4分)工业上由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2 →(步骤Ⅰ)TiCl4  (步骤Ⅱ)Ti
(步骤Ⅱ)Ti
(1)写出步骤Ⅱ中TiCl4→Ti的化学反应方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ·mol-1。
1.(2分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量。请写出该反应的热化学方程式:
________________________________________。
20. 下列混合溶液中,各离子浓度的大小顺序的表示中,正确的是 ( )
A.10 mL 0.10 mol·L-1氨水与10 mL 0.10 mol·L-1盐酸混合
c(Cl-)> c(NH4+)> c(OH -) > c(H+)
B.10 mL 0.10 mol·L-1 NH4Cl溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+) = c(Cl-])> c(OH -)> c(H+)
C.10 mL 0.10 mol·L-1 CH3COOH溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+)= c(CH3COO-) > c(OH -) > c(H+)
D.10 mL 0.50 mol·L-1 CH3COONa溶液与6 mL 1.0 mol·L-1盐酸混合
c(Cl-) > c(Na+)> c(OH -) > c(H+)
高 二 化 学 试 题(A卷)
第Ⅱ卷 (非选择题 共50分)
19.体积相同的甲、乙两个容器,分别都充等量的SO2和O2,在相同温度下发生反应:
2SO2(g)+O2(g)  2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的
( )
2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的
( )
A.等于a% B.大于a% C.小于a% D.无法判断
18.下列离子方程式的书写中,正确的是 ( )
A 过量的NaHSO4与Ba(OH)2溶液反应: Ba2++ OH-+ H++SO42-= BaSO4↓+ H2O
B NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O
C 碳酸氢钠溶液中滴入稀盐酸: HCO3- +H+ = CO2↑+H2O
D FeBr2溶液中通入过量Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
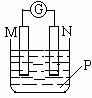
17.如右图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,下表所列M、N、P物质中,可以组合成该装置的是 ( )
|
选项号 |
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸 |
|
B |
铜 |
铁 |
稀盐酸 |
|
C |
银 |
锌 |
 硝酸银溶液 硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁溶液 |
16.在1L 0.3 mol·L-1的NaOH溶液中通入标准状况下CO2 4.48L,恰好完全反应,则下列关系式中,正确的是 ( )
A.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
B.c(Na+)> c(HCO3-) >c(CO32-) >c(OH-)
C.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
 D.c(Na+
)+c(H+)=c(OH-)
+ c(CO32-) + c(HCO3-)
D.c(Na+
)+c(H+)=c(OH-)
+ c(CO32-) + c(HCO3-)
15.在强酸性环境中,下列各组离子能大量共存的是 ( )
A. NH4+、Cl-、NO3-、 Fe2+
B.Fe3+、 ClO-、Na+、SO42-
C. SO42-、Cl-、Na+、Fe3+
D. SO32-、S2-、Na+、K+
14.室温下,将pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液pH=11,则混合时强碱与强酸溶液的体积比是( )
A.11∶1 B.9∶1 C.1∶11 D.1∶9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com