
题目列表(包括答案和解析)
4.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
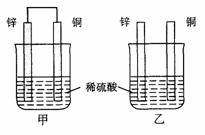 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
2.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:

Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
A.锌 B.汞 C.石墨 D.二氧化锰
2.(7分)向8 g某二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗稀硫酸的体积为100 mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后剩余的混合溶液中,硫酸的物质的量浓度(溶液体积按100mL计算)。
1.(6分)测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否溶解? (填“能”或“不能”),理由是
;
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果 (填“偏高”、“偏低”或“无影响”)。原因是 。
3. (7分)在容积为1L的密闭容器中,充入1 mol N2和4 mol H2,一定条件下反应N2+3H2 2NH3 达到平衡,此时N2和H2的物质的量之比恰好为 1:5。试回答下列问题:
(7分)在容积为1L的密闭容器中,充入1 mol N2和4 mol H2,一定条件下反应N2+3H2 2NH3 达到平衡,此时N2和H2的物质的量之比恰好为 1:5。试回答下列问题:
(1)平衡时混合气体的压强与起始时混合气体的压强相比 (填“偏高”、“偏低”或“相等”)。
(2)该平衡混合气中NH3的体积分数是 。
(3)平衡时,H2的转化率为 。
2.(6分)在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c (H2)= 0.0080 mol·L-1
(1)则该反应的平衡常数K=______ ________。
(2)在上述温度下,该容器中若通入H2和I2各0.20mol 的气态混合物,求达到化学平衡状态时,各反应物的浓度 [H2]= ________ mol·L-1, [HI]= ______________ mol·L-1。
1.(5分)将1 molI2(g)和2 mol H2(g)置于2L密闭容器中,在一定
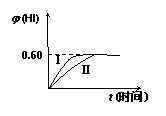 温度下发生反应:
温度下发生反应:
 I2(g)+H2(g) 2HI(g) DH<0,并达到平衡。HI的体积分数j(HI) 随时间的变化如曲线(II)所示。
I2(g)+H2(g) 2HI(g) DH<0,并达到平衡。HI的体积分数j(HI) 随时间的变化如曲线(II)所示。
(1)达到平衡后,I2(g)的物质的量浓度为 ;
(2)若改变反应条件,在某条件下j(HI)的变化如曲线(Ⅰ)所示,则该条件可能是 (填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当的催化剂
4.(5分)(1)将0.15mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2= 。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合而得,则溶液的
pH 7(选填“大于或等于”、 “小于或等于”、 “等于”)。
②若溶液pH>7,则c (Na+) c(A-)(选填“>”、 “<”、 “=”)。
③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法中,正确的是
(填选项符号字母)
A.若反应后溶液呈中性,则反应后溶液中[H+]+ [OH-]=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com