
题目列表(包括答案和解析)
1.下列叙述中,正确的是
①能发生酯化反应的酸一定是羧酸 ②油脂水解后得到的醇都是丙三醇 ③天然蛋白质水解的最后产物是多种α-氨基酸 ④淀粉、纤维素、油脂都是高分子化合物 ⑤蛋白质溶液中加入饱和K2SO4溶液后,蛋白质从溶液中析出,这种变化叫变性
A.只有③ B. ①③ C.②③ D.①④⑤
32. (1)S。 (2)CH4<NH3<H2O; 共价键和离子键; 离子晶体;  。
。
(3)CO32 -+H2O HCO3- +OH- 或 C2O42 -+H2O
HCO3- +OH- 或 C2O42 -+H2O HC2O4- +OH-。 (4)0.3 mol Na2O2、0.1 mol Na2CO3
HC2O4- +OH-。 (4)0.3 mol Na2O2、0.1 mol Na2CO3
本资料由《七彩教育网》 提供!
31. (1)N≡N;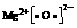 ;第四周期,第VIII族。 (2)①③。 (3)CH4;NH3;NH3+H3O+= NH4+ +H2O。
;第四周期,第VIII族。 (2)①③。 (3)CH4;NH3;NH3+H3O+= NH4+ +H2O。
(4)3SO2+3Ba2++2H2O+2NO3- = 3BaSO4↓+2NO↑+4H+。 SO2。
30.
(1)Mg 1s22s22p6 (2)离子 2F2+2H2O=4HF+O2
(3)b d(B是氧气或氮气)
(4)Na 钠与水反应比镁与反应剧烈后氢扬化钠的碱性比氢氧化镁强(合理即给分)
29.
(1)第三周期 ⅦA (2)2Na+2H2O=2NaOH+H2↑ 大于
(3)大 SiO2是原子晶体 或 小 CO2是分子晶体 (合理即给分)
(4)Cl 高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强(合理即给分)
28.
(1)S C
(2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr 四 +6
(4)F-H…F F-H…O O-H…F O-H…O
27.(1)分子 干冰
(2)正四面体 非极性 Si3N4
(3)三角锥形 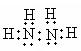
(4)CS2
CCl4 (2分)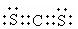 非极性
非极性
26.
(1)CaC2 CaO CO2 Ca(OH)2 C2H2
(2)Ca(OH)2+2CO2=Ca(HCO3)2 (3)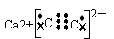

32. (07年高考理综重庆卷·29) (14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)__________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
Ⅱ卷非选择题答案:
31. (07年高考理综天津卷·26)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为______________;XW的电子式为__________________;Z元素在周期表中的位置是_________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明___________________________________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________。
由此可知VW和YW2还原性较强的是(写化学式)____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com