
题目列表(包括答案和解析)
9.(2007年高考海南化学卷,反应速率)(9分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量 /g |
金属 状态 |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________
______________________________________________________。
8. (2007年高考广东化学卷,化学速率) (8分)“碘钟”实验中,3I-+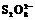 =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(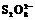 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
7. (06年北京卷)下列说法正确的是( C )
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 C.废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源 D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
Ⅱ卷非选择题
6. (03年江苏10)下列有关纯铁的描述正确的是
A 熔点比生铁的低
B 与相同浓度的盐酸反应生成氢气的速率比生铁的快
C 在潮湿空气中比生铁容易被腐蚀
D 在冷的浓硫酸中可钝化
5.(06年上海16) 将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
4.(06年广东19) 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)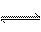 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
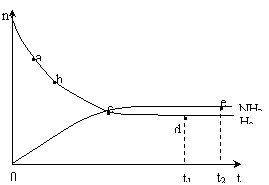
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
3. (06年四川理科综合13)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是
A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B、反应开始到10s,X的物质的量浓度减少了0.79mol/L
C、反应开始到10s时,Y的转化率为79.0%
D、反应的化学方程式为:X(g)+ Y(g) Z(g)
Z(g)
2. (07年高考广东理基·26)把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是D
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量Na2SO4
(试题来源于2003-2008年高考试题)
Ⅰ卷选择题
1.(08年广东理基·36)对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
27.已知在标准状况下,11.2L的HCl气体。回答下列问题:
(1)HCl的物质的量为多少?
(2)该气体用水全部吸收,并配制成2L的盐酸溶液,求HCl的物质的量浓度?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com