
题目列表(包括答案和解析)
6.在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量l mol/L盐酸反应时,速率最快的是 ( )
A.镁 B.铝 C.锌 D.铁
5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是 ( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
4.100 mL浓度为2 mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol/L的硫酸 B.适当加热
C.加入适量蒸馏水 D.加入适量的稀硝酸
3.在下列过程中,需要加快化学反应速率的是 ( )
A.钢铁腐蚀 B.食物腐败 C.炼钢 D.塑料老化
2.某一反应物的浓度是1.0 mol/L,经过20 s后,它的浓度变成了0.2 mol/L,在这20 s内它的反应速率为 ( )
A.0.04 B.0.04 mol/(L·s) C.0.8 mol(L·s)-1 D.0.04 mol/L
1.在某一化学反应中,反应物B的浓度在5 s内从2.0 mol/L变成0.5 mol/L,在这5 s内B的化学反应速率为 ( )
A.0.3 B.0.3 mol/(L·s) C.0.4 mol(L·s)-1 D.0.04 mol/L
10. 答案](10分)(1)abcd (2)a c
(3)①3Fe+4H2O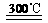 Fe3O4+2H2 ②c ③e
Fe3O4+2H2 ②c ③e
本资料由《七彩教育网》 提供!
9. [答案](1)固体反应物的表面积; 表面积越大; 1和2(或4和5)。 (2)1、3、4、6、8;或2和5。 (3)反应温度; 6和7,8和9。 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
8. [命题意图]考查学生对影响化学反应速率的外界因素(如浓度、温度)及其规律的认识和理解;考查学生对图表的观察、分析以及处理实验数据归纳出合理结论的能力。
[答案](1)研究反应物I-与 的浓度对反应速率的影响。 (2)29.3 s。 (3)A。
的浓度对反应速率的影响。 (2)29.3 s。 (3)A。
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
[提示](2)实验⑤的反应速率应是①的3倍,所以t1 = 88.0/3 = 29.3。 (3)每升高10 ℃,速率增大到原来的2-4倍,现升高20 ℃,所以升高到原来的22-42倍,即4-16倍,实验③为22 s,显色时间应为22/4-22/16,即5.5 s-1.4 s,选A。
10.(08年江苏化学·18)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2 b.CO2 + 3H2
C6H12O6+6O2 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
d.2CO2 + 6H2
CH3COOH
d.2CO2 + 6H2 CH2==CH2
+ 4H2O
CH2==CH2
+ 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
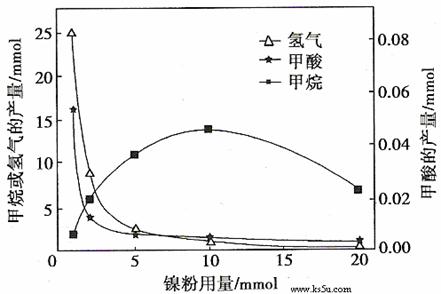
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2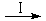 HCOOH
HCOOH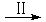 CH4
CH4
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
Ⅱ卷非选择题答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com