
题目列表(包括答案和解析)
4、 反应4 NH3 + 5 O2
= 4 NO + 6 H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol ,则此反应的平均速率V(X) (表示反应物的消耗速率或生成物的生成速率)为( )
反应4 NH3 + 5 O2
= 4 NO + 6 H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol ,则此反应的平均速率V(X) (表示反应物的消耗速率或生成物的生成速率)为( )

 A、V(O2)=0.01mol /(L·s)
B、V(NO)=0.008 mol /(L·s)
A、V(O2)=0.01mol /(L·s)
B、V(NO)=0.008 mol /(L·s)

 C、V(H2O)=0.003 mol /(L·s)
D、V(NH3)=0.0025 mol /(L·s)
C、V(H2O)=0.003 mol /(L·s)
D、V(NH3)=0.0025 mol /(L·s)
5、下列关于金属元素性质的叙述正确的是( )
A、金属元素在化合物中一般显正价 B、离子化合物中一定含有金属元素
C、金属元素只有金属性,没有非金属性
D、金属原子只有还原性,金属阳离子只有氧化性
3、可作为可逆反应 N2(g)+O2(g) 2 NO(g)已达到平衡状态的标志的是( )
2 NO(g)已达到平衡状态的标志的是( )
A、单位时间内每生成 n mol N2 ,同时生成2 n mol NO
B、容器内反应混合物的总压强不随时间改变
C、O2的消耗速率等于NO的消耗速率 D、容器内始终有N2、、O2和NO共存
2、铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是( )
A、FeSO4 B、Na2CO3 C、KNO3 D、KCl
1、下列说法不正确的是( )
A、空气中的NO2等氮氧化合物是造成光化学烟雾的主要原因
B、NO、CO有剧毒都是因为它们易与血液中的血红蛋白结合
C、白磷、HPO3、P2O5有剧毒,红磷、H3PO4无毒
D、白磷保存在水中,NO可用向上排空气法收集
28.已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
 我们跟踪测定H2O的物质的量浓度,
我们跟踪测定H2O的物质的量浓度,
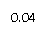
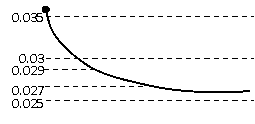
 如图所示:
如图所示:
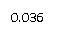 则0~20min的反应速率是
则0~20min的反应速率是
从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
27.(10分)在我校食堂南侧的绿树青草间,有一由井水形成的弯弯小溪。近来发现,昔日那碧波澄清的水面上,泛起了棕红色的“水锈”,小煞风景。
(1)根据学过的知识,你认为该“水锈”的主要成分可能是(写化学式) 。
(2)怎样用化学方法检验此“水锈”的主要成分?简述实验操作:
第一步:取含“水锈”的混浊液少许于试管;
第二步: ;
第三步: 。
上述有关反应的离子方程式为 、
。
26.(6分)在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉-KI溶液 ②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
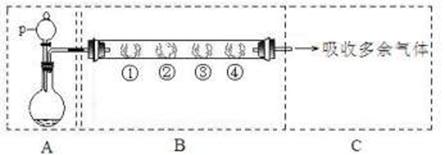
回答下列问题:
(1)p中盛装试剂的名称为 。
(2)反应开始后,观察到的实验现象是:
①处: ;②处: ;
③处: 。
(3)写出④处反应的离子方式: 。
25.(8分)已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
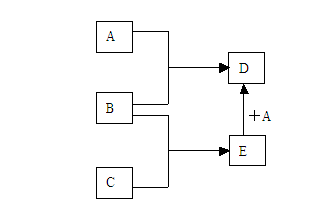
请回答:
(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为______,A和E在一定条件下反应生成D的化学方程式为
___________ __。
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为不含氧元素的酸,且C的组成中含有与A相同的元素。则C的化学式为___________,A和E在一定条件下反应生成D的离子方程式 _____ __。
24.(9分)如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
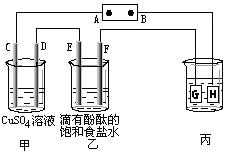
请回答:
(1)A极是电源的 ,甲装置观察到的现象是 、
、 。
(2)C极的电极反应式为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是
溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com