
题目列表(包括答案和解析)
23. (6分)某学生欲用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是
A. 酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B. 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D. 读取盐酸体积时,开始时仰视读数,滴定结束时俯视读数
22. 用pH试纸测定某氨基酸溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,溶液pH的测得值为8,则该氨基酸溶液的实际pH
A. 大于8 B. 小于8 C. 等于8 D. 无法确定
21. 下列各溶液中,微粒的物质的量浓度关系正确的是
 A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1mol·L-1的NaHCO3溶液中:c(OH-)>c(CO32-)
C. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
20. 向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1其原因可能是
向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1其原因可能是
A. 两溶液的体积相同,酸是多元强酸
B. 若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C. 两溶液的体积相同,酸是弱酸
D. 酸是强酸,且酸溶液的浓度比NaOH溶液的浓度大
19. 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li +LiMn2O4= Li2Mn2O4。下列说法正确的是
A. 放电时,LiMn2O4发生氧化反应
B. 放电时,正极的反应式为:Li+LiMn2O4+e-=Li2Mn2O4
C. 充电时,Li2Mn2O4发生氧化反应
D. 充电时,阴极的反应式为:Li++e-= Li
18. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C. 向反应后的溶液加入乙醇,溶液不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应。
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
17. A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法中正确的是
A. A和M的原子序数之差为8
B. A和M原子的电子总数之和可能是11
C. A和M原子的最外层电子数之和为8
D. A和M原子的最外层电子数之差为7
16. 为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=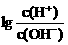 。已知某澄清溶液常温下的AG=12,则在此溶液中能大量共存的离子组为
。已知某澄清溶液常温下的AG=12,则在此溶液中能大量共存的离子组为
A. Na+、AlO2-、K+、ClO- B. MnO4-、K+、SO32-、Na+
C. Mg2+、SO42-、HCO3-、Na+ D. NH4+、NO3-、Al3+、Cl-
15. 能用键能的大小作为主要依据解释的是
A. 稀有气体一般难以发生化学反应
 B. 氮气的化学性质比氧气稳定
B. 氮气的化学性质比氧气稳定
C. 二氧化碳是一种直线型分子
D. 硝酸是挥发性酸,而硫酸是不挥发性酸
14. 在一密闭容器中,有可逆反应X(g)+Y(g)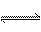 2Z(g)+R(g),下列不能说明反应已达到平衡的是
2Z(g)+R(g),下列不能说明反应已达到平衡的是
A. X的生成速率与R的生成速率相同
 B. 容器内压强不随时间而变化
B. 容器内压强不随时间而变化
C. X、Y、Z、R的浓度相等
D. X、Y、Z、R的浓度不随时间而变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com