
题目列表(包括答案和解析)
5.中学化学实验中常见的使用温度计有如下3种情形:①温度计的水银球浸没在液体反应物液面以下并接近容器的底部;②温度计的水银球置于水浴中;③温度计的水银球置于蒸馏烧瓶的支管处。下列实验使用温度计正确的是
A.苯的硝化反应 ①
B.酒精和浓硫酸混合加热制乙烯: ①
C.测定硝酸钾在水中的溶解度 ③
D.分离苯和硝基苯的混合物 ②
4.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,可用于潜水艇
推进器等。制备某种磁流体时,将等物质的量的硫酸亚铁溶液和硫酸铁溶液混合,滴稍过量的氢氧化钠溶液,随后加入油酸钠溶液,所得磁流体的黑色粒子直径在5.5 nm-36 nm之间。下列说法正确的是
A.油酸钠化学式为C15H31COONa,既含有亲水基又含有憎水基
B.所得磁流体中黑色粒子是胶体,不能透过半透膜
C.对该磁流体进行电泳实验时阴极周围黑色加深
D.所得磁流体的黑色粒子为氧化亚铁
3.下列说法中错误的是
A.通常蔗糖和淀粉都不显还原性
B.纤维素分子是由糖单元组成的,可以表现出一些多元醇的性质
C.油脂是热能最高的营养物质
D.铜盐可以使蛋白质产生盐析
2.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,
衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而被除去,下列衣料中不能用
加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤⑥
1.C3N4和Si3N4晶体结构相似,是新型的非金属高温结构陶瓷。下列说法正确的是
A.C3N4和Si3N4晶体中含有共价键
B.C3N4和Si3N4的晶体都属于分子晶体
C.C3N4和Si3N4易溶于水且熔点低
D.C3N4晶体的硬度比Si3N4晶体的硬度小
29、 铜是日常生活中常见的金属。已知铜的原子序数为29。回答下列问题:
铜是日常生活中常见的金属。已知铜的原子序数为29。回答下列问题:
 (1)写出Cu的核外电子排布式
(1)写出Cu的核外电子排布式
 (2)Cu在周期表中的位置是
(2)Cu在周期表中的位置是
 (3)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式
(3)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式
 (4)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(4)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
 (5)写出你所设计装置中的化学反应的方程式
(5)写出你所设计装置中的化学反应的方程式



28、
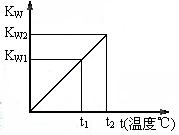 水的离子积常数KW与温度t(℃)的关系如右图所示:
水的离子积常数KW与温度t(℃)的关系如右图所示:
 (1)若t1=25℃,则KW1=_______ ;
(1)若t1=25℃,则KW1=_______ ;
 若t2=100℃时,KW2=10-12,则此时0.05mol·L-1的Ba(OH)2
若t2=100℃时,KW2=10-12,则此时0.05mol·L-1的Ba(OH)2
 溶液的pH=_______。
溶液的pH=_______。
 (2)已知25℃时,0.1L0.1mol·L-1的NaA溶液的pH=10,则NaA
(2)已知25℃时,0.1L0.1mol·L-1的NaA溶液的pH=10,则NaA
 溶液中所存在的平衡有:
溶液中所存在的平衡有:

 溶液中各离子的物质的量浓度由大到小的顺序为
。
溶液中各离子的物质的量浓度由大到小的顺序为
。
 (3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___________。
 (4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强碱的pH与强碱的pH之间应满足的关系为:
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强碱的pH与强碱的pH之间应满足的关系为:
 pH(酸)+pH(碱)=_______________。
pH(酸)+pH(碱)=_______________。
27、 恒温时,将3 mol A和2 mol B气体通入固定容积为2L密闭容器中发生反应:
恒温时,将3 mol A和2 mol B气体通入固定容积为2L密闭容器中发生反应:

 3A(g) + B(g ) xC (g) 。2min时反应处于平衡状态,此时容器内剩余1.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
3A(g) + B(g ) xC (g) 。2min时反应处于平衡状态,此时容器内剩余1.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
 (1)x =
(1)x =
 (2)从反应开始到平衡状态,A的平均反应速率为
(2)从反应开始到平衡状态,A的平均反应速率为
 (3)A的转化率与B的转化率的比为
(3)A的转化率与B的转化率的比为
 (4)保持温度和容积不变,在上述容器中继续加入1.5 mol A和1 mol B,则A的转化率为
(4)保持温度和容积不变,在上述容器中继续加入1.5 mol A和1 mol B,则A的转化率为
 (5)保持温度和容积不变,起始时充入a molA、b
molB、c
molC,欲使其反应达平衡
(5)保持温度和容积不变,起始时充入a molA、b
molB、c
molC,欲使其反应达平衡
 时C的物质的量分数与上述平衡相同,则a、b、c应满足的关系为:
时C的物质的量分数与上述平衡相同,则a、b、c应满足的关系为:
 (6)对于上述反应,达到平衡的标志是
(6)对于上述反应,达到平衡的标志是
 A、容器内压强不再改变 B、容器内密度不再改变
A、容器内压强不再改变 B、容器内密度不再改变
 C、容器内气体的相对分子质量不再改变 D、容器内各物质的浓度不再改变
C、容器内气体的相对分子质量不再改变 D、容器内各物质的浓度不再改变
26、 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:
 (1)甲池若为用电解精炼铜的装置,A极是_________
(1)甲池若为用电解精炼铜的装置,A极是_________
 (填“阴极”或“阳极”),其电极反应为______________
,
(填“阴极”或“阳极”),其电极反应为______________
,
 B材料是_______,电解质溶液为_________。
B材料是_______,电解质溶液为_________。
 (2)若甲槽阴极增重12.8g,则乙槽阴极放出气体的物质的量
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体的物质的量
 为_________。
为_________。
 (3)将乙槽产生的气体混合点燃反应产生热量为Q kJ/mol,写出该反应的热化学方程式
(3)将乙槽产生的气体混合点燃反应产生热量为Q kJ/mol,写出该反应的热化学方程式
 。
。
 (4)乙槽电解时反应的方程式为
。
(4)乙槽电解时反应的方程式为
。
25、
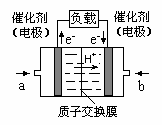 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示
 意图如下。甲醇在催化剂作用下提供质子(H+)和电子。电子
意图如下。甲醇在催化剂作用下提供质子(H+)和电子。电子
 经外电路、质子经内电路到达另一极与氧气反应。该电池总反
经外电路、质子经内电路到达另一极与氧气反应。该电池总反
 应式为: 2CH3OH+3O2===2CO2+4H2O。下列说法中正确的是
应式为: 2CH3OH+3O2===2CO2+4H2O。下列说法中正确的是

 A、右边的电极为电池的负极,b处通入的是空气
A、右边的电极为电池的负极,b处通入的是空气
 B、左边的电极为电池的负极,a处通入的是甲醇
B、左边的电极为电池的负极,a处通入的是甲醇
 C、电池负极的反应式为:CH3OH+H2O=CO2+6H++4e-
C、电池负极的反应式为:CH3OH+H2O=CO2+6H++4e-
 D、电池正极的反应式为:O2+2H2O-4e-=4OH-
D、电池正极的反应式为:O2+2H2O-4e-=4OH-



 第Ⅱ卷(共50分)
第Ⅱ卷(共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com