
题目列表(包括答案和解析)
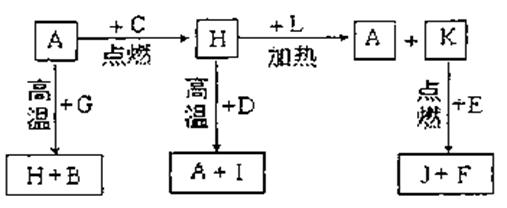
22.(10分) A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
 请回答下列问题:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程
式 。
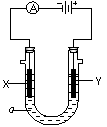 23、(8分)电解原理在化学工业中有广泛的应用。如图
23、(8分)电解原理在化学工业中有广泛的应用。如图
表示一个电解池,装有电解液a;X、Y是两块电极板,
通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是______ _____,
在X极附近观察到的现象是________ ____。
②Y电极上的电极反应式为_____ ______,
检验该电极反应产物的方法是
。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应是_________________________。
②Y电极的材料是____________,电极反应是_________________________。
(说明:杂质发生的电极反应不必写出)
21.(10分)某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A. 移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B. 用标准溶液润洗滴定管2~3次
C. 把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D. 取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E. 调节液面至0或0以下刻度,记下读数
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。 就此实验完成填空:
⑴正确操作步骤的顺序是(用序号字母填写)_____________。
⑵上述B步骤操作的目的是_____________________________。
⑶上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是__________________________ 。
⑷判断到达滴定终点的实验现象是:_________________。
⑸若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是______________________________________。
20.已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液下列叙述中不正确的是:
A.该温度高于25℃
B.水电离出来的c(H+)=1×10-10mol/L C.c(Na+)+c(H+)=c(OH-)+2c(SO42-)
D.该温度下加入等pH为12的NaOH溶液可使反应后的溶液恰好呈中性
第Ⅱ卷(非选择题:共36分)
19.下列说法中错误的是:
A.某一可逆反应,若反应物和生成物的系数相同,则达到平衡时,反应物和生成物的浓度一定相同
B.某一特定可逆反应,只要其他条件不变,不论是否使用催化剂,平衡时产物的浓度总是一定的
C.将N2和H2按1:3的体积比充入密闭容器中,进行合成氨反应,当正、逆反应速率相等后,反应达到平衡,混合气中N2和H2的体积比为1:3
D.将压强为1KPa的2NO2  N2O4平衡体系体积缩小到原来的一半,重新达到平衡时,压强为2Kpa
N2O4平衡体系体积缩小到原来的一半,重新达到平衡时,压强为2Kpa
18.氢氧燃料电池是一种高性能电池,总反应为2H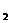 +O
+O =2H
=2H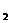 O,电解质溶液为KOH溶液,下列有关该电池的叙述中错误的是
(
)
O,电解质溶液为KOH溶液,下列有关该电池的叙述中错误的是
(
)
A、H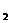 为负极,O
为负极,O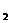 为正极
为正极
B、工作时电解质溶液的pH不断增大
C、负极反应:2H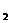 -4e
-4e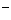 +4OH
+4OH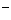 =4H
=4H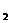 O
O
D、正极反应:O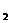 +4e
+4e +2H
+2H O=4OH
O=4OH
17.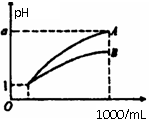 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是 ( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是 ( )
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后,A酸溶液的酸性比B酸溶液强
C、若a=4,则A是强酸,B是弱酸
D、若1<a<4,则A、B都是弱酸
16.一元强酸HA的水溶液在加适量碱MOH后,溶液呈中性,下列判断中,正确的是:
A.加入碱过量 B.反应反溶液c(A-)=c(M+)
C.生成的盐不水解 D.酸与碱等物质的量混合
15.下列说法正确的是 ( )
A.过量的铁粉加入FeCl3、HCl、CuCl2的混合溶液中,充分反应后阳离子主要是Fe3+
B.在海轮的船壳上镶嵌锌块能起到防止钢铁腐蚀的作用
C.光导纤维非常细,导光能力非常强,能同时传输大量信息,光导纤维是由硅晶体制成的
D.硫酸工厂的尾气中,常含有SO2等有害气体,如果直接排入大气,可能形成光化学烟雾
14、在101kPa和25℃时,有反应的热化学方程式:H2(g) + 1/2O2(g) =H2O(g);
△H=-241.8kJ/mol,H2(g) + 1/2O2(g) =H2O(1);△H=-285.8kJ/mol。下列说法中错误的是:
A、H2燃烧生成1molH2O(g)时,放出241.8kJ的热量
B、H2的燃烧热为285.8kJ
C、O2 前面的1/2表示参加反应的O2的物质的量
D、1mol液态水变成水蒸气时吸收44kJ的热量
13、已知某溶液中滴加酚酞试液显红色,其中能大量存在的离子是 ( )
A、NH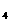
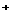 、Ba
、Ba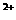 、AlO
、AlO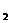
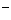 、Cl
、Cl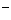 B、SO
B、SO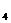
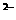 、NO
、NO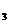
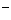 、Fe
、Fe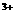 、Al
、Al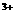
C、 Cl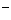 、SO
、SO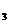
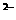 、Na
、Na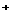 、K
、K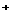 D、Na
D、Na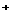 、K
、K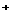 、HCO
、HCO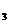
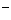 、Cl
、Cl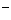
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com